- Размножение хосты, способы и рекомендации
- как размножить хосту листьями? Как рассадить растение летом? Когда можно размножать черенкованием? Правильный уход после посадки
- Размножение хосты. 3 способа – Ваш надёжный дом
- Все о размножении хосты семенами, листьями, черенками (посадка, дальнейший уход)
- Размножение хосты весной | Размножение растений
- когда можно делить куст и рассаживать? Как рассадить хосту летом? Как разделить куст не выкапывая его? Пересадка весной и осенью
- Особенности выращивания
- Как пересаживать многолетник?
- Посадка хосты
- Особенности рассаживания в разное время
- Особенности ухода за цветком
- Как размножить делением куста?
- Подкормка и удобрения цветка
- Черенкование хост
- Обрезка хосты
- Как рассадить хосту летом?
- Пересадка
- Когда проводить деление кустарника?
- Способы размножения
- Размножение хосты делением куста
- Цветение хосты
- Даже неприхотливый многолетник требует уход.
- Популярные виды (сорта)
- Советы и предупреждения
- Трудности выращивания растения. Полезные советы
- Размножение делением куста и черенкованием
- Почему не растет хоста, какого ухода ей не хватает?
- Болезни и вредители
- Три способа размножения хост
- Воспроизведение: Паразиты выбирают лучшее из обоих миров
- Репликация вирусов | Британское общество иммунологии
- вирусных инфекций и хостов | Безграничная биология
- вирусов | Национальное географическое общество
- Биология и репликация коронавируса: последствия для SARS-CoV-2
- Активность кишечной дельта-6-десатуразы определяет диапазон хозяев для полового размножения токсоплазмы
- Abstract
- Введение
- Результаты и обсуждение
- Линолевая кислота имеет решающее значение для полового развития в культивируемых клетках кошек
- Ингибирование дельта-6-десатуразы вызывает половое развитие в клеточных культурах мышиных клеток
- Ингибирование дельта-6-десатуразы вызывает половое развитие у живых мышей
- Ооцисты, полученные от мышей, спорулируют и являются инфекционными
- Заключительные замечания
- Материалы и методы
- Заявление об этике
- Органоиды кишечника
- Кишечные монослои и добавление жирных кислот
- Приготовление и заражение брадизоитом
- Ингибирование дельта-6-десатуразы
- Иммунофлуоресценция
- Срезы тканей и гистология
- ПЦР в реальном времени на кДНК подвздошной кишки
- ПЦР в реальном времени для
- ПЦР монослоев кишечника кошек
- Статистические методы
- Споруляция ооцист и инфекции мышей
- Вестерн иммуноблот
- Дополнительная информация
- S1 Рис. Количественное определение мерозоитов в культуре ткани мышей.
- S2 Рис. Оценка инфекционности ооцист мышей по конверсии сыворотки.
- S3 Рис. Ооцисты мыши заразны.
- S1 Данные. Исходные данные для рис. 2а.
- S2 Данные. Исходные данные для рис. 2б.
- S3 Данные. Исходные данные для рис. 3h.
- S4 Данные. Необработанные данные для S1 Рис.
- S5 Данные. Исходные данные для рис. 5а.
- S6 Данные. Исходные данные для рис. 6а.
- Данные S7. Исходные данные для рис. 6б.
- Благодарности
- Список литературы
- Знакомство с вирусами
Размножение хосты, способы и рекомендации
Самым распространённым способом размножения хосты является деление куста и черенкование. Обычно, хоста легко переносит деление взрослых кустов (4 года), и в будущем на развитии растения это ни как не сказывается.
Деление куста в раннем возрасте может притормозить нормальный темп роста хосты, однако и данный факт зависит от видовых и сортовых особенностей растения. Кое-какие сорта хосты в раннем возрасте прекрасно переносят деление, некоторые могут в течение 2 лет почти не развиваться. Касается это молодых растений, размножение которых проводилось методом invitro.
Лучшим сроком для деления кустов хосты является весна или конец лета. Однако, опытные садоводы делят хосты практически весь сезон. Весной, как только появляются молодые побеги, хосту нужно выкопать и делить при помощи вил, лопаты или острого ножа. Вначале вилы необходимо свести, взявшись за ручки, а затем раздвинуть как можно шире, корневая система при этом травмируется намного меньше, чем при разрезании куста ножом или лопатой.
Порой при делении куста случайно обрезаются или отламываются побеги-розетки почти без корней, но с куском корневища – «пяточкой». Такой черенок нужно высадить отдельно в парник или же в тень, под прозрачную пластиковую бутылку, где, обычно, он укореняется в течение нескольких недель.
Для быстрейшего укоренения хосты, листву у черенков рекомендуется обрезать наполовину. Как правило, черенками размножают молоденькие кусты хост или срезают отдельные розетки у взрослых растений, при этом, не выкапывая их из почвы. Порой это бывает очень трудно сделать, потому что у некоторых сортов хосты побеги растут плотно к другу другу и не всегда удаётся удачно срезать черенок.
Также хосты можно размножать семенами, все-таки не все сорта с большой лёгкостью завязывают семена, также влияют и погодные условия.
Как правило, да и сеянцы, не сохраняют сортовых признаков, обычно так размножают видовые хосты, разрастающиеся медленно.
Семенное потомство некоторых хост бывает очень разнообразным, и данное свойство довольно широко используется в селекции. Посев собранных семян осуществляется под зиму или проводится для них холодная стратификация в течение 4 месяцев. Развиваются сеянцы медленно и декоративного эффекта лишь достигают на пятый год жизни.
Хочется рассказать о самом эффективном и современном
При микроклональном методе размножения хост отделённая от материнского растения почка помещается в искусственную среду, обеспечивая необходимый световой и температурный режим, при этом постоянно сохраняя определённую влажность. Выросшие растения через пару недель адаптируются к новым условиям и их снова можно поделить на почки и черенки и вновь посадить в пробирки для размножения.
Выросшие растения через пару недель адаптируются к новым условиям и их снова можно поделить на почки и черенки и вновь посадить в пробирки для размножения.
Микроклональный метод размножения хосты позволяет круглогодично и в короткие сроки получить сотни тысяч растений из одного побега или почки маточного растения. Единственным недостатком этого метода является распространение вирусных заболеваний, к большому сожалению, случается это не редко.
Меристемное размножение, применяется для оздоровления маточного растения от опасных инфекций. Клетки, находящиеся в глубине почек, называют меристемными и в них наличие вирусов минимально. Под микроскопом после оздоровительных процедур удаляют фрагменты меристемной ткани, затем их переносят в искусственную среду, где клетки дают новым растениям жизнь. Каждое такое растение подвергается сложным анализам для проверки на вирусную инфекцию, при подозрении проводится выбраковка, и лишь из здоровых растений отбирают клоны для следующего размножения.
К сожалению не всегда размноженные invitro хосты сохраняют сто процентные сортовые особенности материнских растений.
Поэтому обязательным этапом данного метода размножения данного растения является проверка на сортовую чистоту. Но многие фирмы пренебрегают этим проверкам, торопясь как можно быстрее распространить новые сорта и преследуя при этом только коммерческие интересы. Поэтому покупать нужно сортовые хосты, размноженные invitro с закрытой корневой системой и с развёрнутыми листьями, тогда вы сможете точно сравнить растение с оригинальным сортом.
как размножить хосту листьями? Как рассадить растение летом? Когда можно размножать черенкованием? Правильный уход после посадки
Хоста – это многолетнее травянистое растение семейства Спаржевых. Оно представлено в виде кустов, которые состоят из прикорневых листьев, при этом цветки очень похожи на изысканные лилии. Многие садоводы и дачники садят у себя на участке хосту благодаря её нетребовательности в уходе и привлекательному внешнему виду. Рассмотрим подробнее особенности размножения хосты, оптимальные сроки и тонкости посадки, а также дальнейший уход.
Многие садоводы и дачники садят у себя на участке хосту благодаря её нетребовательности в уходе и привлекательному внешнему виду. Рассмотрим подробнее особенности размножения хосты, оптимальные сроки и тонкости посадки, а также дальнейший уход.
Оптимальные сроки
Размножение хосты – это довольно простой процесс, но стоит ознакомиться с некоторыми нюансами, чтобы не возникло никаких проблем. Лучше всего заниматься высадкой семян весной. Отличное время – апрель. Если размножение хосты будет происходить делением куста или черенками, тогда можно заниматься размножением не только весной, но и летом – в июне или июле. Кроме того, при необходимости деление куста можно производить даже в начале осени.
Изначально стоит произвести подготовку посадочного материала, а также выбрать место, где можно рассаживать хосту.
Рассмотрим подробнее основные варианты размножения хосты.
Как размножить делением куста?
Одним из способов размножения хост выступает деление кустов. Этот способ можно использовать только в том случае, если имеется взрослая особь – это растение, которое растёт на одном месте без пересадки уже 6 лет. Этот способ обычно используют в конце апреля или в начале мая, хотя можно проводить деление как в конце летнего периода, так и в начале осени.
Чтобы быстро рассадить хосту, следует придерживаться следующего алгоритма действий.
- Сначала нужно выкопать куст хосты.
- Стоит поделить куст на части, при этом каждая должна иметь две точки роста, а также хорошую корневую систему.
- Все места среза следует тщательно обработать с помощью древесного угля.
- Выбрать место для посадки, создав лунки под посадку.
 При этом глубина ямки должна составлять 25 см, а расстояние между лунками – 35 см.
При этом глубина ямки должна составлять 25 см, а расстояние между лунками – 35 см. - Если близко проходят грунтовые воды, тогда стоит положить в ямки дренаж.
- 2/3 ямки стоит наполнить питательной смесью, создав так называемый холмик. Для создания этой смеси применяется торф и компост в одинаковых пропорциях.
- Поставить хосту в центре холмика, тщательно уложить корневую систему.
- Присыпать растение грунтом и хорошенько полить под корень.
- Произвести мульчирование при помощи торфа или коры.
Важно! После посадки тока роста должна быть с почвой на одном уровне, поэтому почвосмесь нужно либо убрать, либо досыпать.
Черенкование
 Размножение черенками пользуется спросом, поскольку можно довольно быстро создать целую клумбу из хост, при этом минимально повредив корневую систему. Размножение этим способом подразумевает высадку побегов на коротких черешках и с небольшими листочками. Отличным временем для этого метода является лето. Лучше производить укоренение в конце июня или в начале июля.
Размножение черенками пользуется спросом, поскольку можно довольно быстро создать целую клумбу из хост, при этом минимально повредив корневую систему. Размножение этим способом подразумевает высадку побегов на коротких черешках и с небольшими листочками. Отличным временем для этого метода является лето. Лучше производить укоренение в конце июня или в начале июля.Рассмотрим пошагово алгоритм действий.
- Выбрать черенок. Он должен иметь точку росту, с него стоит на 1/3 часть удалить листики.
- Выбрать место с питательным грунтом и произвести посадку.
- Тщательно полить посаженный черенок.
Стоит обратить внимание, что первые 5 дней после посадки являются очень важными, ведь они определяют дальнейший рост черенка.
Если растению не уделять внимания, то оно довольно быстро завянет и заболеет. Черенки после посадки нуждаются в регулярном поливе, а также опрыскивании листочков. Со временем каждый черенок начнёт образовывать свою крепкую корневую систему. И уже буквально через несколько недель растение начнёт активно расти.
Черенки после посадки нуждаются в регулярном поливе, а также опрыскивании листочков. Со временем каждый черенок начнёт образовывать свою крепкую корневую систему. И уже буквально через несколько недель растение начнёт активно расти.
Семенной способ
Ещё одним методом размножения являются семена. Стоит отметить, что хоста не всегда формирует цветоносы. Некоторые сорта вообще не имеют цветков, поэтому нет и семян. Такие экземпляры могут размножаться исключительно вегетативно. Особенность семенного способа заключается в том, что молодые растения не имеют материнских черт.
Тёмно-коричневые семена продолговатой формы достигают в длину от 0,5 до 1 см. Они образуются в жёлтых коробочках, которые остаются после отцветшего цветка. Через 7–8 недель после опыления растение можно считать зрелым. Этот период обычно наступает в конце августа или в начале сентября. Стоит поймать момент, когда коробочки с семечками становятся бурыми, засыхают и открываются, именно в это время стоит начинать сбор. Далее семена следует тщательно просушить, при этом температура должна быть +30 +35 градусов. Обычно хватает 5–10 минут для полного высыхания.
Через 7–8 недель после опыления растение можно считать зрелым. Этот период обычно наступает в конце августа или в начале сентября. Стоит поймать момент, когда коробочки с семечками становятся бурыми, засыхают и открываются, именно в это время стоит начинать сбор. Далее семена следует тщательно просушить, при этом температура должна быть +30 +35 градусов. Обычно хватает 5–10 минут для полного высыхания.
После этого семена следует очистить от крылатки и поставить на один месяц в холодильник.
Если есть необходимость в хранении семян, тогда их стоит паковать в пакетики по 30–50 штук. Семена следует хранить в тёмном и сухом месте, которое защищено от детей. Следует придерживаться температуры воздуха от +10 до +40 градусов. В среднем срок годности составляет 2 года. Если произвести посадку семян правильно, «детки» все равно будут вялыми, они будут расти довольно медленно, при этом листочки не превысят в диаметре 1,5 см. Уже следующий год позволит растениям окрепнуть и догнать в росте, они приобретают уже окончательный окрас.
Уже следующий год позволит растениям окрепнуть и догнать в росте, они приобретают уже окончательный окрас.
Стоит остановиться подробнее и на всхожести семян, поскольку они довольно быстро её теряют. Всхожесть хосты составляет не более 70%. По этой причине специалисты советуют производить посев семян сразу после сбора в питательную почву. Следует быть готовым, что семена всходят довольно плохо. Обычно семенами размножаются такие сорта хосты, как Allegan Fog, Revolution и Sharmon. Рекомендуется обработать семена стимулятором роста, например, замочить в растворе «Циркона» или «Эпина».
Семенной способ размножения заключается в следующем.
- Семена стоит обработать для лучшей всхожести ростостимулятором.
- В почвосмеси следует сделать борозды.
- Семена следует углублять в почву всего на 6–7 мм.

- После посадки их стоит присыпать перлитом и грунтом. Стоит немного уплотнить посадку.
Важно! Специалисты рекомендуют производить посадку семян при температуре воздуха +20 градусов. Если такая температура продержится некоторое время, то всхожесть семян будет лучше.
Лучше высеивать семена в плошки, а в дальнейшем с помощью пикировки пересаживать их в открытый грунт. Оптимальным выбором для посадки семян выступают горшочки из пластика, на дне которых сделано много дырочек. Изначально контейнеры следует пролить кипящей водой, далее обработать спиртом и только после этого наполнять почвосмесью, при этом можно применять исключительно стерильную.
Оптимальным выбором является грунт, приобретённый в специализированном магазине. Если вы остановили свой выбор на домашнем грунте, тогда его стоит дополнить кристалликами перлита, марганцовки или торфа. Говорить о декоративности сорта хосты, выращенного из семян, можно только через 4–5 лет после посадки. Но такое длительное ожидание не мешает селекционерам выводить новые сорта.
Говорить о декоративности сорта хосты, выращенного из семян, можно только через 4–5 лет после посадки. Но такое длительное ожидание не мешает селекционерам выводить новые сорта.
С помощью этого метода размножения можно создать свой уникальный сорт с удивительным окрасом.
Правила посадки
Хосты – довольно востребованные растения, которые способны расти и радовать окружающих удивительным цветением на протяжении 20 лет, при этом без пересадки. Размножение хосты является довольно простым и интересным. Придерживаясь несложных рекомендаций касательно посадки, можно создавать красивые и привлекательные клумбы с хостами. Специалисты рекомендуют выполнять следующие правила при посадке:
- оптимальное место для посадки хосты – это тень или полутень, следует выбирать почву с ровной поверхностью;
- обязательно стоит принять во внимание, что в хосты довольно сильно разрастаются корни, поэтому стоит делать широкие и большие лунки для посадки;
- в среднем следует придерживаться расстояния между растениями в 80 см;
- неплодородную почву стоит дополнительно обогатить перлитом, вермикулитом и торфом;
- после посадки грунт стоит уплотнить так, чтобы в этом месте земля была на несколько сантиметров выше;
- в прикорневую зону следует добавить мульчу, отличным выбором станет измельчённая кора.

Дальнейший уход
Хоста является нетребовательным растением, она не нуждается в тщательном уходе, но стоит придерживаться элементарных правил, чтобы она долго росла и радовала глаз привлекательным внешним видом. Итак, при уходе за хостой стоит обратить внимание на несколько нюансов.
Полив
Растение нельзя назвать влаголюбивым. Достаточно производить полив раз в 3 дня. Если хоста произрастает на сыром или заболоченном участке, то её следует быстрее пересадить, иначе она просто завянет.
Обрезка
Хоста может обходиться и без обрезки. Оптимальный вариант – производить обрезку раз в год, при этом лучшее время – весна. Эта процедура скорее является профилактической. Во время обрезки следует уменьшить размер листиков, убрать гнилые и старые участки.
Во время обрезки следует уменьшить размер листиков, убрать гнилые и старые участки.
Удобрение
Органические удобрения – лучшее решение для подкормки хосты. Их следует вносить в почву под корень непосредственно после полива. Многие отдают предпочтение настою коровяка, его рекомендуется вносить 2 раза в год. Если использовать минеральные удобрения в виде гранул, тогда их следует углубить в почву вокруг хосты.
Следует использовать компост для мульчирования земли хотя бы раз в год, что позволит поддерживать оптимальный уровень влажности.
Пересадка
Хотя хоста не нуждается обычно в пересадке, поскольку она может произрастать на одном месте до 20 лет, но она не боится этого процесса, обычно чувствует себя после неё отлично. Пересадку рекомендуется осуществлять, когда хоста произрастает в неподходящих условиях или сильно разрастается. Хосту не рекомендуется садить в том месте, где ранее росла хоста, если срок меньше 5 лет, чтобы избежать болезней. Если нельзя изменить место посадки, тогда следует произвести полную замену почвы.
Пересадку рекомендуется осуществлять, когда хоста произрастает в неподходящих условиях или сильно разрастается. Хосту не рекомендуется садить в том месте, где ранее росла хоста, если срок меньше 5 лет, чтобы избежать болезней. Если нельзя изменить место посадки, тогда следует произвести полную замену почвы.
Подготовка к зиме
Касательно этого вопроса существуют разные мнения. Некоторые специалисты советуют в начале ноября срезать растение под корень, другие утверждают, что хоста отлично переносит зимы, при этом её не нужно трогать, достаточно укрыть с помощью плёнки, нетканки или мешковины.
Про размножение хосты смотрите далее.
youtube.com/embed/8t3lSme63Fg?modestbranding=1&iv_load_policy=3&rel=0″/>
Размножение хосты. 3 способа – Ваш надёжный дом
Хосты распространены на всем Земном шаре и являются неотъемлемой частью композиции ландшафтного дизайна. Хосты могут выручить при оформлении проблемных участков (затененных, малоплодородных, склонных к засолению) без потери своей декоративности. Хосты радуют своей красотой уже ранней весной, а желтеть и засыхать листья начинают только поздней осенью.
Они хорошо переживают суровые зимы, не боятся заморозков. Жизнестойкость хост сочетается с их высокой способностью разрастаться и буквально за два-три года закрывать всю отведенную территорию. В связи с этим размножение хосты не вызывает особых трудностей.Наиболее распространенные способы размножения хост: деление куста и черенкование. Вегетативное размножение наиболее важно при сохранении сортовых признаков растения. При семенном размножении сеянцы плохо растут, декоративные кусты формируются только на четвертый год.
Размножение хосты делением куста
Деление куста хост можно проводить в два срока: ранняя весна (апрель-май) и начало осени (сентябрь). Куст делят на довольно мелкие деленки с одной или двумя розетками листьев. Не следует беспокоиться, что куст получится слишком слабым, так как уже за два-три года он сможет развиться в полноценный декоративный куст. Более крупные деленки с четырьмя розетками листьев делают в том случае, когда необходимо размножить медленнорастущий сорт, либо если в получении большого количества растений нет необходимости.
Деленки высаживают в подготовленную почву, предварительно обильно политую, в лунки глубиной 20 – 25 см. Заглублять отдельные части поделенного куста необходимо до заметок на растениях (след от почвы).
Для нормального формирования и развития куста деленки высаживают на расстоянии 30 см (с допустимым отклонением в 5 см). Первые дни после посадки растения обильно поливают для лучшего укоренения.
Hosta ‘Abba Irresistable’
Черенкование хост
Для черенкования хосты благоприятным временем считается достаточно продолжительный период с конца мая по конец июля. В качестве черенков берут молодые побеги с «пяткой», при этом предпочтение лучше отдавать побегам с более мелкими листьями на коротких черешках. Техника черенкования хост довольно общая. У черенков срезу после срезки подрезают на треть листья. Эта мера помогает снизить испарение. Несколько дней после посадки черенки болеют, листья сильно увядают и ложатся на почву. В это время их необходимо регулярно поливать и опрыскивать водой, укрывать от прямых солнечных лучей. Через три дня растения восстанавливают нормальный тургор, и листья «оживают».
В качестве черенков берут молодые побеги с «пяткой», при этом предпочтение лучше отдавать побегам с более мелкими листьями на коротких черешках. Техника черенкования хост довольно общая. У черенков срезу после срезки подрезают на треть листья. Эта мера помогает снизить испарение. Несколько дней после посадки черенки болеют, листья сильно увядают и ложатся на почву. В это время их необходимо регулярно поливать и опрыскивать водой, укрывать от прямых солнечных лучей. Через три дня растения восстанавливают нормальный тургор, и листья «оживают».
Хосты хорошо подходят для размножения in-vitro в лабораторных условиях. Такой метод позволяет получать из небольшого кусочка меристемы десятки молодых растений в течение круглого года. Метод является высоко рентабельным и имеет важное экономическое значение в цветоводстве.
Hosta ‘Abby’
Семенной способ размножения хост
В случае с размножением семенами не избежать появления растений с традиционными зелеными листьями – так проявляется закон расщепления признака. Однако такой поворот, возможно, наоборот, заинтересует цветоводов-экспериментаторов.
Однако такой поворот, возможно, наоборот, заинтересует цветоводов-экспериментаторов.
Сеянцы растут очень медленно, образуя за первый год меленькие листочки диаметром 1–1,5 см. На второй год листочки несколько увеличиваются, но неоднородно в посевах. В это время у листьев появляется типичная окраска будущего куста. Выход сеянцев с пестрой неоднородной окраской очень маленький. Повысить этот показатель можно за счет семян с растений, имеющих листья различной окраски и интенсивности.
Посев осуществляется семенами, не прошедшими стратификацию. Всходы появляются быстро, но недружно (некоторые семена долго не прорастают). Очень часто семена за несколько месяцев хранения теряют всхожесть, поэтому сеять лучше сразу после сбора. У каждого сорта имеется определенный выход жизнеспособных семян, при этом различны сроки созревания. Семена пригодные для посева имеют темную окраску.
Интересные сорта для семенного размножения «Sharmon», «Revolution», «Allegan Fog», которые имеют штриховки, пятна, крапинки, могут дать много пестрых сеянцев. Однако процент жизнеспособных семян у этих сортов пока неизвестен.
Однако процент жизнеспособных семян у этих сортов пока неизвестен.
Hosta ‘Sharmon’
Hosta ‘Revolution’
Hosta ‘Allegan Fog’
Все о размножении хосты семенами, листьями, черенками (посадка, дальнейший уход)
Хоста – представитель рода многолетних травянистых растений, которые относятся к семейству Спаржевых. Представляют собой плотные кусты, образованные прикорневыми листьями. Цветки напоминают лилии.
Это растение очень любят многие садоводы, дачники, так как оно является неприхотливым и отличается завидной стабильной декоративностью. Когда неопытные владельцы участков видят это растение, то задаются вопросом, касающимся разведения: «как размножаются растения хосты?».
В этой статье рассмотрены, как размножается хоста, существующие для этого способы, а также, что собой представляют ее семена.
Хоста
Способы размножения
Размножается растение хоста, как и все представители семейства Спаржевых, 3 вариантами:
- Семенами.

- Розетками листьев.
- Черенками.
Размножение хосты семенами
Очевидный плюс данного способа – получение здоровых, более выносливых, стойких к погодным условиям растений. Чаще всего его применяют селекционеры. Садоводам требуется набраться терпения, так как размножение семенами – длительный процесс.
Посев семян на рассаду производят в начале апреля.
Семена хосты
Семена растения хоста выглядят, как продолговатые темно-коричневые «изюмины» в длину 0,5-1 см. Располагаются в желтых коробочках на месте отцветивших цветков.
Как собирать
Растение становится зрелым на 7-8 неделю после опыления. Происходит это примерно в конце лета, начале осени. Важно не пропустить момент, когда коробочки побуреют, засохнут и откроются. Это сигнал того, что пора запасаться материалом.
Сбор длится до полного усыхания коробочки, начала гниения, не больше 3-5 дней.
Собранные семена сушат при температуре 300-350 градусов по Цельсию до максимального испарения влаги (около 5-10 минут занимает процесс сушки), очищают от крылатки и помещают в холодильник на 1 месяц.
Как хранить
Хранить в маленьких пакетиках по 30-50 шт. в сухом, темном и защищённом от детей месте. Температура – от 10 до 40 градусов по Цельсию.
Срок годности – 2 года.
Подготовка семян
Из-за плохого прорастание семян (рассаду дают не более 70%) их предварительно обрабатывают стимуляторами роста: выдерживают в растворах эпина, циркона.
Подготовка емкости
Идеальным место для выращивания рассады является пластиковый горшочек с множеством отверстий на донышке. Тщательной обработке подвергаются контейнеры для выращивания: их проливают кипящей водой, после обрабатывают спиртом.
Почва тоже должна быть стерильной. Лучше всего приобрести магазинный грунт. Если берут домашнюю землю, то обязательно добавляют кристаллы марганцовки, перлит, торф.
Лучше всего приобрести магазинный грунт
Важно! Если не учитывать правила стерилизации, растения вырастут болезненными, хилыми.
Посадка семян
На дно чистых емкостей засыпают дренаж, субстрат. Далее идет слой влажного грунта, немного его утрамбовывают. Семена необходимо рассадить по поверхности, засыпать почвой, слоем не более 1 см.
Далее идет слой влажного грунта, немного его утрамбовывают. Семена необходимо рассадить по поверхности, засыпать почвой, слоем не более 1 см.
Сверху емкости натягивают пленку.
Уход за рассадой
Будущую рассаду ставят в такое место, чтобы на нее не попадали прямые солнечные лучи
Будущую рассаду ставят в такое место, чтобы на нее не попадали прямые солнечные лучи. Температура в помещении должна поддерживаться на уровне 18-25 градусов по Цельсию. Ежедневно необходимо приоткрывать пленку на 2 часа. Поливают умеренно, не допуская застоя воды.
Первые расточки появляются через 2-3 недели.
Когда образуются 2 листочка на ростке, начинают пикировать рассаду (пересаживать в более плодородную почву). Помещают в почвосмесь, присыпанную песком. Увлажняют методом нижнего полива.
После пикирования пленку убирают, уже через 7 дней начинают выносить на воздух каждый день на 2-3 часа, если температура выше 18 градусов по Цельсию.
Высадка рассады в открытый грунт
Высаживать в почву на участке нужно при температуре не меньше 20 градусов по Цельсию./how-to-plant-hostas-3963861-02-0261919572b846bea476082f3a592b70.jpg) Идеальным условием для выращивания будет тень. Лунки делают на расстоянии 0,5-0,7 м друг от друга.
Идеальным условием для выращивания будет тень. Лунки делают на расстоянии 0,5-0,7 м друг от друга.
Перед посадкой почву рассады увлажняют, вместе с комом земли вытаскивают из горшочка и сажают в грунт. Присыпают, немного утрамбовывают.
Размножение хосты делением листьев
Метод достаточно не трудоемкий, сравнительно быстрый. По сравнению с размножением семенами, не требует больших затрат времени.
Важно учесть! При размножении листьями нужно в точности соблюдать технологию укорочения листьев, условия содержания.
Этапы размножения хосты листьями
Размножение хосты делением листьев
Лучшим временем для выращивания является начало лета либо середина весны. Проводится работа в следующей последовательности:
- После появления побегов необходимо обрезать молодые розетки с куском корневища (пяточкой) острым лезвием. Место среза обрабатывают песком.
- Листья высаживают отдельно в парник либо в тенистое место под прозрачную пластиковую бутылку.

- В течение 3-4 недель они удлиняются. В это время их необходимо поливать по мере высыхания, поднимать бутылку необходимо не более на 1-2 часа в день.
- После разрастания их выкапывают вилами, пересаживают на постоянное место, утрамбовывают, после поливают водой.
Как размножить хосту черенками
3 способ такой же быстрый, как и размножение листьями. Чаще всего его применяют садоводы. Если размножать хосту черенками, то вырастит гибридный экземпляр своему родителю.
Инструкция, как черенкуют хосту
Весь процесс протекает очень легко и не требует больших затрат времени, сил:
- Ø В качестве черенков необходимо присмотреть молодые побеги с «пяткой», мелкими листками на коротких черешках. Срезают их острым ножом.
- Ø Сразу после черенкования хосты побеги подрезают на треть листа.
- Ø Посадочный материал располагают в тени или притеняют.
- Ø Поливают ежедневно.
Обратите внимание! Первые 3-5 дней черенки выглядят вялыми, безжизненными. Не стоит спешить от них избавиться. Через некоторое время они поднимаются.
Не стоит спешить от них избавиться. Через некоторое время они поднимаются.
Правила посадки
При выращивании следует учесть следующие нюансы:
- o Для размножения лучше всего взять место, которое находится в полутени или в тени. Желательно поверхность должна быть абсолютно ровной.
- o При посадке необходимо учесть разрастание корня – лунки надо делать побольше и шире.
- o Расстояние между хостами – около 0,8 м.
- o Если почва недостаточно плодородная, то лучше всего добавить в нее торф, вермикулит, перлит.
- o Присыпают почву и уплотняют ее так, чтобы уровень земли в этом месте был на пару сантиметров ниже.
- o Желательно добавить в прикорневой участок мульчу в виде измельченной коры.
Уход
Хоста требует минимального, но соответствующего требованиям ухода. При его соблюдении можно не сомневаться, что растение будет расти еще длительное время.
Полив
Осуществлять его необходимо по мере засыхания почвы – примерно 1 раз в 3 дня. Заболоченные, сырые участки хоста не переносит.
Заболоченные, сырые участки хоста не переносит.
Обрезка
Растение почти не нуждается в обрезке. Достаточно лишь 1 раз в год (весной) проводить профилактическую процедуру: уменьшать размер листовой пластины, срезать старые, гнилые участки.
Удобрение
Для подкормки лучше всего подходят органические удобрения, которые вносятся под корень после полива. Чаще всего используют настой коровяка 2 раза в год: летом и весной.
Гранулы минерального удобрения можно заделывать в почву вокруг растения.
Хотя бы раз в год грунт стоит мульчировать компостом. Это обеспечит сохранение влаги.
Чаще всего используют настой коровяка
Пересадка
Хоста прекрасно переносит пересадку. Проводят ее обычно в 2 случаях:
- o Неподходящие условия.
- o Разрастание растения.
Обратите внимание! В течение 5 лет не рекомендуют пересаживать растение туда, где уже росла хоста, во избежание заболеваний. Если такая необходимость есть, можно провести замену грунта.
Если такая необходимость есть, можно провести замену грунта.
Подготовка к зимнему периоду
Мнения на этот счет противоречивы. Одни советуют срезать растение под корень в начале ноября, другие говорят о том, что хоста и без этого хорошо переносит зиму.
Обратите внимание! Если хосту не срезают, то ее рекомендуют укрыть. Подойдут мешковина, нетканка, пленка.
У прочитавшего эту статью человека теперь не возникнет вопрос, как размножать хосту в домашних условиях. Провести хоста размножение можно легко, выбрав для себя удобный метод и не затратив большого количества времени. В итоге садовод или дачник получит великолепное декоративное растение на своем участке.
5 1 голос
Рейтинг статьи
Размножение хосты весной | Размножение растений
Размножение хосты лучше проводить весной в апреле месяце. Все зависит от региона выращивания растения. В центральных и южных районах размножение хосты делением куста проводим в апреле месяце. Именно в этот период весны проклевываются первые побеги. Побеги хосты, достигшие в длину 5-10 см, сигнализируют нам о начале размножения.
Все зависит от региона выращивания растения. В центральных и южных районах размножение хосты делением куста проводим в апреле месяце. Именно в этот период весны проклевываются первые побеги. Побеги хосты, достигшие в длину 5-10 см, сигнализируют нам о начале размножения.
Размножение хосты делением куста
Выкапываем маточный куст для его деления. Чем взрослее куст, тем больше выкапываем ком земли с корнями. Острым предметом разрезаем куст хосты предназначенный для весеннего размножения на четыре части. Конечно, разделить куст на четыре равные половины не получится, но это не помеха для удачного размножения.
Выбирать место для посадки необходимо в тени или полутени плодовых деревьев или строений. Большое количество разновидностей растений хосты получают ожоги на солнце, особенно в обеденное время в пик солнцепека. Поэтому оптимальным местом для посадки подорожниковой хосты будет такое место, где солнце попадает на листья растений в утренние и вечерние часы.
На данном примере рассмотрим посадку хосты предназначенную для размножения в тени плодовых деревьев. Для начала выкапываем ямки согласно размерам отделенного куска от маточника с небольшим запасом. Аккуратно помещаем саженец хосты в углубление. Пространство вокруг саженца засыпаем компостом, перепревшим навозом или огородной землей.
Посадка хосты
При посадке в лунку необходимо сверху компоста добавить препарат от личинок майского жука и минеральное удобрение. В состав удобрения обычно входит азот, фосфор, калий. Сверху удобрения насыпаем небольшой слой земли. Хорошо проливаем высаженный саженец и ждем пока вода впитается. После впитывания воды добавляем землю, при необходимости слегка вдавливаем саженец хосты до уровня земли.
Обратите внимание, землю добавляем после впитывания воды. Это позволит избежать образования земляной корки после высыхания, которая незначительно, но все же мешает дышать корням растения.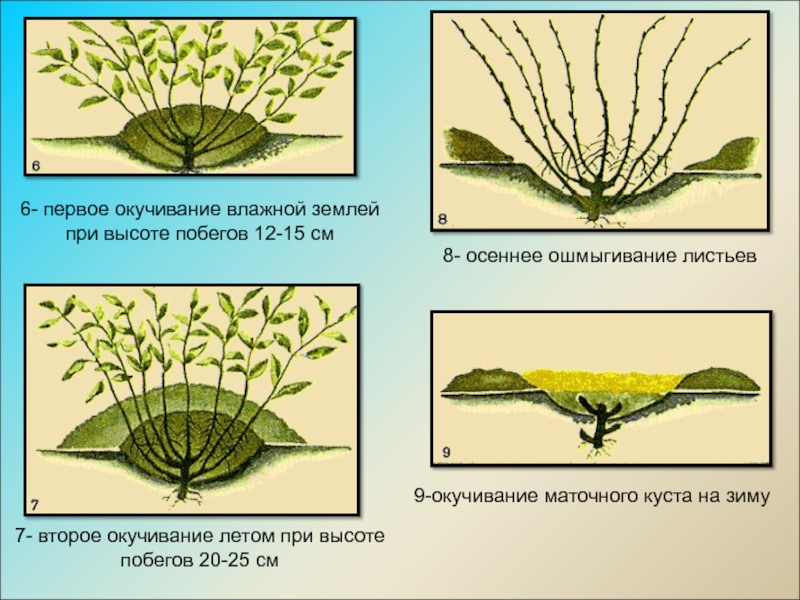 Обильный полив высаженной хосты проводим через один два дня на протяжении 7-14 дней до полной приживаемости.
Обильный полив высаженной хосты проводим через один два дня на протяжении 7-14 дней до полной приживаемости.
Место маточника хосты, как правило, находится по соседству с другими кустами. Иногда оголяются корни хосты растущие рядом. Поэтому пространство выкопанного саженца необходимо засыпать огородной землей или компостом. Засыпая углубление компостом, мы проводим подкормку растения и защищаем корни.
Хоста красивое, пышное растение, доставляющее истинное наслаждение от изобилия красок листьев,ароматов и цветов. Читайте, вникайте, применяйте!
когда можно делить куст и рассаживать? Как рассадить хосту летом? Как разделить куст не выкапывая его? Пересадка весной и осенью
Особенности выращивания
Многообразие окрасок и размеров являются не единственным достоинством хосты. Цветоводов и ландшафтных дизайнеров растение подкупает своей удивительной неприхотливость, высокой морозостойкостью и способностью расти практически в любых условиях. Можно подобрать сорта для тенистых участков, полутени и даже солнечных мест. Высокорослые сорта помогут создать эффект тропического сада, низкорослые украсят бордюры и рабатки. Уместна хоста будет и в оформлении водоема.
Как пересаживать многолетник?
Хоста размножается делением куста, черенкованием, и методом посева семян. Первый способ применяется в конце лета: корень делится на части, которые пересаживаются на новые места. Точно так же отделяются от корневой системы куста молодые черенки.
Точно так же отделяются от корневой системы куста молодые черенки.
Хоста из семян?
Хоста, действительно, хорошо размножается семенами. При посадке семенами предварительно обработайте посевной материал корневином, эпином, или другими стимуляторами роста. Если этого не сделать, процент схожести составляет не более 75%. Некоторые цветоводы утверждают, что повысить качество семян можно, поместив их на несколько месяцев в прохладное место. Посев семян производится во втором или третьем месяце весны.
Почва для посадки семян должна быть стерильной. Лучший вариант — специальная грунтосмесь, купленная в цветочных магазинах. В её состав должны входить вермикулит, перлит, и торф.
Посадка хосты
Посадка хосты в грунт предельно проста, требует минимальных знаний и под силу даже новичкам. Обычно растения хорошо приживаются на новом месте.
Способы посадки
Участок перед посадкой необходимо хорошо вскопать на глубину 30 см. Желательно под перекопку внести органические удобрения.
Интересно! Сорняки не способны конкурировать с хостами. Большие листья растения способны вытеснить любого конкурента.
Расстояние между растениями нужно выбирать с учетом их роста. Необходимо учитывать разрастание корневища вширь и оставлять растению необходимое место. Оптимальное расстояние между растениями составляет 30‑60 см.
Оптимальное время для посадки
Посадку растения рекомендуется проводить весной (апрель ‑ начало мая). В течение первого месяца после посадки обязательно регулярно поливать растение, что дать ему возможность хорошо укорениться.
Почва для растения
К составу почв растение особых требований не предъявляет и может расти практически на любых грунтах. Только тяжелые суглинистые почвы и песчаные требуют улучшения. На них хоста плохо растет. Желательно чтобы кислотность была близка к нейтральной (рН 6,5—7,5).
Хоста очень хорошо реагирует на обилие в почве органических веществ, поэтому кроме внесения во время посадки органических удобрений, растение нужно регулярно мульчировать компостом.
Посадка осенью
Осенняя посадка нежелательна, но если выхода не остается, то лучше проводить ее в конце августа ‑ начале сентября. К исключениям можно отнести хосты Зибольда и Токудама, которые рекомендуется высаживаться только осенью. Считается, что сорта и гибриды этих видов наращивают корни после того как листья полностью развернулись, поэтому весной могут засохнуть быстрее чем укоренятся.
Посадка весной
Для большинства видов весенняя посадка предпочтительней, особенно если есть возможность с осени подготовить посадочную яму. Растения высаживают, когда минует угроза возвратных заморозков.
Особенности рассаживания в разное время
Размножить хосту путём деления можно весной, пожалуй, это лучшее время для отделения побегов с корнями. Благодаря этому происходит омолаживание материнского куста, который пускает свои силы на рост молодых веток и более крупных листьев. Разделить растение правильно поможет точное выполнение необходимых требований.
- Понадобится окопать землю вокруг хосты. Чтобы приподнять куст, в качестве рычага применяется посадочная садовая вилка. При больших размерах кустарника и внушительных габаритах земляного кома садоводу потребует помощь ещё одного человека. Когда растение извлечено, его корни нужно погрузить в раствор марганцовокислого калия, при необходимости убрать с них улиток и слизней.
- Деление производится при помощи острого инструмента, предварительно обработанного антисептиком. Разделение происходит по ростовым точкам, при этом удаляются травмированные, подгнившие или сухие отростки корневища.
- Посадочная яма делается на порядок глубже и шире объёма корней, которые должны располагаться в земле свободно. Дополнительно можно внести в неё фосфорные, калиевые и азотсодержащие удобрения, которые в весеннее время особенно актуальны.
- Качественная посадка предусматривает исключение воздушных пустот у корневища и уплотнение грунта. Поскольку пышно растущие кусты создают неудобство при прополке, землю под ними разумнее замульчировать. К тому же это предотвратит иссушение почвы и появление некоторых видов вредителей.
Идеальное время для проведения работ – середина апреля, первые числа мая, поскольку позднее растение может быть подвержено потере влаги из-за жаркой погоды и засухи, в то время как оно будет находиться в активной фазе вегетации. Осенью необходимо учитывать климатические условия региона. Это важно, чтобы молодые растения смогли адаптироваться, нарастить корни и набраться сил до наступления холодов. Опытные садоводы считают, что лучше пересаживать хосту в сентябре, не менее чем за месяц до заморозков. Корни растения пребывают в спящем состоянии, благодаря этому хосте наносится минимальный ущерб.
Однако понятно, что более поздняя посадка может быть опасна для здоровья и жизнеспособности кустарника. Особенностью осеннего деления является срезание листьев и сохранение лишь стеблей длиной не более 15 см.
Особенности ухода за цветком
Хоста требует минимального ухода. Единственный фактор, влияющий на рост и развитие ‑ это почвенная влага.
Местоположение и освещение для растения
При выборе местоположения необходимо учитывать особенности видов и сортов. Большинство цветоводов ценят хосту за способность расти в тени, где другие растения просто не выживут. Однако существуют виды и сорта, прекрасно растущие на солнце.
Определить уровень освещения необходимый сорту можно по краске листьев. Сорта с однотонной зеленой или голубой окраской листьев хорошо растут в тени и полутени. Сорта с незначительным вкраплением более светлых цветов выдержат полутень. Сорта, у которых основной цвет листьев желтый или белый с незначительным вкраплением зеленого, нуждаются в ярком свете.
Интересно! При посадке в тень пестролистная хоста может изменять свою окраску и становиться полностью зеленой. Только пересадка на более светло место поможет вернуть первоначальный вид.
Влажность воздуха
Растения любят повышенную влажность воздуха, т. к. в природе большинство видов растут во влажных ласах или поймах рек. Особенно пышно растут хосты, высаженные возле водоемов. Однако при регулярном поливе и поддержании почвы во влажном состоянии естественного уровня влажности растению будет вполне достаточно.
Как правильно поливать
Хоста чрезвычайно влаголюбива, но не любит слишком сырых заболоченных участков. Почву желательно все время поддерживать влажной. При этом почва должна быть хорошо дренированной и насыщенной кислородом.
Как размножить делением куста?
Одним из способов размножения хост выступает деление кустов. Этот способ можно использовать только в том случае, если имеется взрослая особь – это растение, которое растёт на одном месте без пересадки уже 6 лет. Этот способ обычно используют в конце апреля или в начале мая, хотя можно проводить деление как в конце летнего периода, так и в начале осени.
Чтобы быстро рассадить хосту, следует придерживаться следующего алгоритма действий.
- Сначала нужно выкопать куст хосты.
- Стоит поделить куст на части, при этом каждая должна иметь две точки роста, а также хорошую корневую систему.
- Все места среза следует тщательно обработать с помощью древесного угля.
- Выбрать место для посадки, создав лунки под посадку. При этом глубина ямки должна составлять 25 см, а расстояние между лунками – 35 см.
- Если близко проходят грунтовые воды, тогда стоит положить в ямки дренаж.
- 2/3 ямки стоит наполнить питательной смесью, создав так называемый холмик. Для создания этой смеси применяется торф и компост в одинаковых пропорциях.
- Поставить хосту в центре холмика, тщательно уложить корневую систему.
- Присыпать растение грунтом и хорошенько полить под корень.
- Произвести мульчирование при помощи торфа или коры.
Важно! После посадки тока роста должна быть с почвой на одном уровне, поэтому почвосмесь нужно либо убрать, либо досыпать.
Подкормка и удобрения цветка
Хоста нуждается в подкормках, особенно органическими удобрениями. Возможно подкармливать растение 2 способами:
- Внекорневым;
- Корневым.
Самый привычный и простой способ это внесение удобрений под корень после полива. Таки образом рекомендуется подкармливать растение настоем коровяка 2 раза в год: весной и летом. Гранулы минерального удобрения можно просто заделывать в землю вокруг растения.
Совет! Почву вокруг растения стоит мульчировать компостом. Это позволит сохранить влагу и обеспечит необходимые питательные вещества.
Внекорневую подкормку проводят водорастворимыми минеральными удобрениями. Листья опрыскивают водой с небольшой концентрацией удобрений.
Совет! Не стоит злоупотреблять подкормками во второй половине лета, т. к. бурное развитие растений не позволяет им вовремя подготовиться к зиме.
Черенкование хост
Размножение хосты листьями позволяет сохранить все особенности материнского растения, как, впрочем, и при размножении делением куста. Можно ли размножить хосту листом – интересная тема и заслуживает внимания, так как такой способ позволяет обзавестись завидной клумбой быстро и без травмирования корневой системы.
Размножение хосты листьями заключается в высадке побегов с маленькими листовыми пластинами на коротких черешках. Оптимальное время – лето, а именно, конец июня – начало июля.
- Взять подходящий черенок с точкой роста и удалить на 1/3 листики.
- Высадить посадочный материал на постоянное место в питательную почву (используют тот же состав, что и при высадке деленок).
- Обильно полить водой.
Примечательно, что хоста, размножение черенками которой проводилось в первые дни, теряет свой тургор. Она очень вянет и болеет. Именно поэтому в первые 5 дней после посадки ее необходимо регулярно поливать утром и опрыскивать листики. Спустя некоторое время растение подымится и начнет образовывать корневую систему, а пройдет еще несколько недель – и она начнет активно развиваться.
Обрезка хосты
Хоста практически не нуждается в обрезке.
Способы обрезки
При пересадке иногда рекомендуют уменьшать размер листовой пластинки, чтобы снизить испарение. После отцветания стоит срезать засохшие цветоносы. Допускается также обрезать потерявшие декоративность и больные листья.
Обрезка на зиму
Мнения о необходимости осенней обрезки противоречивы. Одни цветоводы советуют полностью срезать листья на зиму, другие – оставлять растение как есть.
Листья хост мягкие и в большинстве случаев весной от них не останется и следа, а питательные вещества после их разложения удобрят землю. В то же время на листьях могут остаться возбудители болезней и вредители. Поэтому принимать решение обрезать или нет, каждый садовод должен самостоятельно.
Информация к размышлению! Считается, что осенью корневище оттягивает из листьев все питательные вещества, поэтому слишком ранняя обрезка будет истощать растение.
Как рассадить хосту летом?
- Одиночные ростки не используются, так как ждать разрастания придётся очень долго. Лучше брать побеги с 2-3 почками. Листва полностью удаляется – это предупреждает интенсивное испарение воды и способствует максимальному развитию корневища.
- Перед процедурой обязателен обильный полив корней материнского куста.
- Все срезы при разделении должны производиться острым обеззараженным инструментом, затем их промазывают зелёнкой и противогрибковыми средствами.
- После пересадки очень важно создать тень для рассаженных саженцев и постоянно поддерживать почву увлажнённой. Деление проводят в пасмурный день или вечером, чтобы палящие лучи не оставили ожоги на срезах.
Пересадка
Пересадку растения переносят хорошо, хотя могут расти на одном место до 20 лет. Проводить эту процедуру приходится если:
- Растение сильно разрослось и необходимо деление;
- Не подходят условия и хоста плохо растет.
Способы пересадки
Если взрослый куст перемещается целиком, то его стоит выкопать с большим комом и пересадить на новое место. Если необходимо деление то корневище слегка отряхивают от земли, чтобы была возможность разрезать куст на несколько частей.
Не рекомендуется высаживать растение на место где уже росли хосты, чтобы избежать заражения заболеваниями. Если такая необходимость существует, то нужно провести замену почвы.
Пересадка осенью
Оптимальное время для осенней пересадки конец августа ‑ начало сентября. После пересадки растение необходимо обильно полить и замульчировать землю, чтобы защитить от возможных заморозков. До наступления холодов должно быть не менее месяца.
Пересадка весной
Весенняя пересадка проводится в конце апреля – начале мая. Именно этого время считается предпочтительным для пересадки. После пересадки землю мульчируют, а растение в первый месяц регулярно поливают, не допуская полной просушки грунта.
Когда проводить деление кустарника?
Важно! Молодые растения до полного укоренения нуждаются в хорошем поливе.
Самый популярный и довольно простой метод размножения — это разделение разросшегося растения на несколько частей.
Важно! Делить желательно только взрослое окрепшее растение, которому не менее 5 лет. Для более молодого куста процедура может вызвать сильный стресс, что замедлит рост.
Лучшим временем считается конец весны — начало лета, но многие садоводы делают это и осенью. В принципе не так важно, когда делить хосту, главное, не делать этого во время цветения и созревания семян и успеть хотя бы за пару недель до заморозков, чтобы растение успело укорениться.
Как разделить хосту на части
Как делить хосту
Чтобы поделить куст, его необходимо извлечь из земли. Для этого цветок обкапывают вокруг и, поддев лопатой, вынимают. Нужно освободить корни от грунта. Для этого достаточно взять хосту пучком и слегка постучать нижней частью по земле. Если почва отходит неохотно, её смывают водой. Важно, чтобы корни были хорошо видны, тогда проще понять, как разделить куст с наименьшим для него уроном.
Обратите внимание! Места срезов желательно присыпать толчёным древесным углем, чтобы предотвратить гниль и попадание бактерий.
Если разделённые части сажают сразу на постоянное место, то интервал между ними должен быть не менее 30 см. Когда саженцы небольшие, и их нужно подрастить, кустики можно располагать ближе. После того как молодые функии окрепнут, их рассаживают на большее расстояние друг от друга.
Лунки делают такими, чтобы корни были немного заглублены, то есть оказались в земле чуть глубже, чем сидели раньше. До посадки растений желательно внести комплексное удобрение и полить лунки, чтобы земля в них пропиталась влагой.
Лучше всего молодые хосты примутся во влажной и рыхлой хорошо дренированной земле, в идеале в гумусной почве с нейтральной или слабокислой реакцией. Нужно замульчировать посадки опилками и обеспечить регулярный полив. При проседании почвы лунки необходимо досыпать земли.
Высадка делёнки
Важно! Место для посадки в тени, полутени или на солнце зависит от вида хосты. Растения с белой серединой у листьев, например, прекрасно себя чувствуют на хорошо освещённых участках, а синие и голубые любят тень.
Некоторые цветоводы рекомендуют срезать у саженцев часть листьев, чтобы уменьшить испарение влаги.
Несмотря на то что любые разновидности хосты могут произрастать на одном месте более 20-25 лет, для омоложения растений необходимо их делить и рассаживать, к тому же эта садовая культура довольно легко переносит разделение и пересадку. Первый признак того, что хосту можно делить – сжимание центральной части кроны кустарника и прекращение её роста.
Но для разделения и пересадки не подойдут совсем молодые, пусть и набравшие объём кусты хосты – начинать процедуру разведения и пересаживания можно лишь в 4-летнем возрасте растения. Далее разделяют взрослые экземпляры раз в 4-6 лет, за это время они успевают набрать силу и выпустить сильные дочерние розетки со здоровыми и крепкими побегами. Для начинающих садоводов важно знать, какими должны быть отделённые саженцы хосты.
- Делёнка представляет собой часть растения с хорошо сформированными корнями и 1-2 листовыми розетками. Если на ветках их 3-4 штуки, саженец считается крупным. Правда, дело даже не в размере, ведь красивого декоративного вида все посаженые побеги достигают к 2 годам. Но садоводу важнее, чтобы растение быстрее достигло максимального размера, и в этом случае лучше выбирать не большие делёнки, а быстрорастущие сорта.
- Специалистами принято использовать одиночные розетки у стремительно разрастающихся сортов, а те, что растут медленно, разделять на крупные части.
- Зрелые кусты в возрасте 5-6 лет делят на 4, старые – на 2-3 части.
Взрослые хосты легко поддаются разделению, главное, придерживаться установленных правил.
- Делить растение в мае, конце августа или в сентябре.
- Применять острые и стерилизованные инструменты (лопатку или нож, в зависимости от размеров хосты).
- У маленького кустарника побег вырезается на расстоянии 10 см от основания, у большого – в 35 см.
- Перед процессом приствольный круг орошается и подкапывается.
- Если не видно корней, допускается смыть с них землю.
- Саженцы нельзя разрезать пополам. Делить куст нужно осторожно, избегая повреждения корней.
- Большие крепкие побеги отрезаются при помощи острого ножа с зубчатым лезвием.
- Приживаемость побега можно увеличить, срезав зелёную массу листвы.
- Слишком запутанные переплетённые корни распутывают садовой вилкой.
- Повреждённые, проблемные части корней следует удалить, укоротить длинные отростки, а затем провести дезинфекцию фунгицидами.
Саженцы помещают в просторные посадочные ямки, заглубляя так, чтобы отростки без листьев остались на поверхности. В завершение процедуры землю уплотняют и хорошо поливают. После этого желательно покрыть почву под делёнками мульчей.
Если не стоит задача получения большого числа делёнок, то 2-3 новых растения можно отделить от исходного куста, не выкапывая его полностью, что, конечно, упрощает процесс. Чтобы аккуратно отделить побеги с 1-4 розетками, необходимо поставить острую лопату в центр корневой системы и треугольником отсечь необходимую часть с корнями и листвой. Нередко дочерние ветки располагаются так, что сразу становится ясно, как провести разделение, разумеется, брать надо только самые сильные побеги.
Когда нужна одна делёнка, её можно просто отделить руками, предварительно подкопав ствол с внешней стороны. Зрелые кустарники спокойно переносят эту процедуру, но молодые хосты, включая 3-летние экземпляры, после столь раннего деления могут начать расти медленнее.
Предлагаем ознакомиться Как размножается сельдь
Наглядно о размножении хосты делением смотрите далее.
Способы размножения
Размножение хосты может проводиться:
- Семенами;
- Делением куста;
- Черенками.
Последние 2 способа используются чаще всего.
Размножение семенами
Размножение семенами помогает получить огромное количество растений, но определенные трудности при таком способе размножения тоже есть. Часто возникают проблемы прорастанием семян, которые можно решить с помощью стратификации. Сенцы слишком мелкие требуют пикировки и доращивания, а минимальную декоративную ценность такое растение приобретет не раньше чем через 4 года.
Важно! Семенной способ не подходит для размножения сортов, т. к. сеянцы не будут наследовать сортовые признаки.
Размножение черенками
Этот способ достаточно травматичен, т. к. требует выкапывания растения. От взрослого растения отделяют молодые побеги с «пяточкой» и высаживают в питательный субстрат. Листья укорачивают на треть. Такую процедуру можно проводить с мая по июнь. Первое время черенки нужно обильно поливать и периодически опрыскивать, чтобы листья не теряли тургор.
Размножение листом
Размножение листом наименее вероятный способ. Получить с помощью листового черенка новое растение тяжело. Для этого у основания черешка должна сохраниться пазушная почка, а лучше, если есть возможность отделить лист с частью стебля.
Деление куста
Оптимальный способ размножения. Взрослый куст можно разделить на несколько частей, который быстро восстановят декоративность и разрастутся на новом месте.
Интересно! В промышленных масштабах хосту размножают с помощью меристемной культуры, что позволяет очистить растение от вирусов и болезней и получить огромное количество посадочного материала выбранного сорта.
Размножение хосты делением куста
Размножение хост делением кустов возможно только при наличии взрослого экземпляра. Созревший куст – это растение, которое развивалось без пересадки на протяжении 6 лет. Оптимальное время для пересадки – третья декада апреля и первая декада мая. Также можно размножать «пеструю красотку» и в конце лета – начале осени.
Для размножения растения делением куста необходимо:
- Выкопать старый экземпляр.
- Разрезать его на деленки с наличием 2 точек роста. Корневая система должна быть хорошо развита и здорова.
- Места среза присыпать древесным углем.
- Выкопать лунки на расстоянии 35 см глубиной 25 см.
- По необходимости уложить дренаж (используется при поверхностных грунтовых водах;
- В ямку насыпать на 2/3 питательную смесь в виде холмика (используется в равных частях компост и торф).
- Разместить растение на холмике, расправить корни по его склонам.
- Присыпать почвой.
- Обильно полить под корень.
- Замульчировать поверхность почвы торфом или корой.
Важно! Точки роста молодых растений должны находиться на одном уровне с грунтом. По необходимости почву либо подсыпают, либо убирают.
Цветение хосты
Цветы хосты весьма привлекательны, хотя и считаются не основным достоинством растения.
Когда цветет растение, форма цветка
Хосты зацветают в июне-августе, в зависимости от вида растения. Цветки держатся 20-40 дней. Хосты ланцетолистная и подорожниковая могут цвести в августе-сентябре.
Цветы хосты достаточно крупные, до 13 см (в зависимости от вида), колокольчатой формы, собраны в соцветия на верхушке длинного цветоноса. Окраска зависит от вида и может быть белой, сиреневой или фиолетовой.
Интересно! Выведены сорта хост с ароматными цветами.
Даже неприхотливый многолетник требует уход.
Уход за хостами предполагает, что вы контролируете два важных момента: высокое содержание гумуса и влажность почвы.
Первые 4 года после посадки удобрения можно не вносить. Достаточно 1 раз в год мульчировать почву вокруг нее. Также допустимо 1 раз в 14 дней использовать жидкие минеральные удобрения в первой половине лета (для бедной земли с низким содержанием полезных веществ).
Почва вокруг куста должна быть постоянно увлажнена. Поливайте ее по утрам, избегайте попадания воды на листья. Следите, чтоб цветок не поражали болезни и вредители. При необходимости используйте специальные препараты, или удаляйте больное растение из участка.
Если вы заметили, что края листьев потемнели, увеличьте полив. Умеренная влага в почве — это основа ухода за этим хостами.
Особенность растения такова, что после цветения розетка теряет форму. Чтоб этого не случилось, некоторые садоводы обрывают цветоносы на этапе формирования. Через 5 лет после посадки от корня можно отделить черенки, и пересадить в другое место.
Сентябрь — время подготовки к покою. Если у многолетника сохранились цветоносы, — удалите их. В этот период можно заняться делением куста.
Популярные виды (сорта)
Систематика рода Хоста до сих пор вызывает бурные дискуссии ботаников, а описание некоторых видов требуют уточнений. Считается, что род насчитывает около 30 видов и гибридов, но некоторые из них были описаны по растениям, введенным в культуру, поэтому не соответствуют видам из естественных мест обитания. Не смотря на путаницу и небольшое количество видов, сады и парки покоряют более 2000 зарегистрированных сортов этого растения.
Виды и сорта хосты принято делить на группы в зависимости от окраски листьев и размеру. Чаще всего в культуре встречаются:
- Хоста подорожниковая (Hosta plantaginea). С ярко-зелеными глянцевыми листьями. Высота растения 50 см, ширина до 90 см. Цветки крупные белые.
- Хоста Зибольда (Нosta sieboldiana). Листья крупные, синеватые, с хорошо заметными жилками. Высота до 60 см. цветки белые.
- Хоста Форчуна (Hosta fortunei). Листья зеленые, с кремовой каймой. Цветки нежно-сиреневого цвета.
- Хоста курчавая (Нosta crispula). С темно-зелеными широкими листьями и белой каймой по краю. Цветки лавандовые.
- Хоста высокая (Нosta elata). Крупное растение, которое может достигать в высоту 1 м. Листья темно-зеленые, глянцевые, крупные. Цветки светло-сиреневые.
- Хоста волнистая (Нosta undulata). Главной изюминкой этого вида являются крупные листья с волнистым краем и белой полосой посередине. Цветки
Советы и предупреждения
Полученный при разделении кустиков хосты материал нужно высаживать на такую же глубину, на которой находился корень материнского куста. При этом расстояние между отдельными растениями должно быть не менее 30-35 см.
При посадке черенков в грунт нежелательно, чтобы листья были большими.
В этом случае из них будет слишком сильно испаряться влага. Чтобы предотвратить это наиболее крупные листья обрезают на одну треть.
При высадке в открытый грунт рекомендуется в верхний слой добавить мульчу. Для этого можно, например, использовать измельченную кору.
«Красавица сада», «королева тени», как только не называют хосту ее почитатели. Многие садоводы отдают этому благородному растению лучшие места на своем участке, обрамляют им клумбы, используют в ландшафтном дизайне. Удовольствие это не из самых дешевых, так как саженец столь роскошного цветка стоит относительно немало. Выход есть — размножение хосты семенами. Именно этой интересной теме посвящен следующий материал.
Трудности выращивания растения. Полезные советы
Как правило, у цветоводов не возникает сложностей с выращивание хост.
Если есть желание задекорировать приствольные круги старых деревьев, то стоит обратить внимание на хосту. С помощью различных сортов можно украсить и осветлить тенистые участки сада.
Продолжительность жизни растения
Хоста может расти около 20 лет, при этом с возрастом красота и декоративность растения только увеличивается.
Почему цветок не цветёт?
Некоторые поздноцветущие хосты в серных регионах просто не успевают зацвести. Если проблема не в видовой принадлежности, то возможно местоположения для цветка выбрано не правильно.
Почему желтеют (сохнут) листья?
Хоста желтеет, а листья подсыхают при недостаточном поливе, особенно при посадке на солнце. Листья скручиваются, а хоста желтеет и сохнет также при поражении различными заболеваниями и вредителями.
Размножение делением куста и черенкованием
Самые распространённые способы размножения хост — деление куста и черенкование. Как правило, функии легко переносят деление взрослых кустов (5-6 лет) и в дальнейшем на развитии растения это не сказывается. В более раннем возрасте деление может притормозить нормальный темп разрастания хосты, но и это зависит от сортовых и видовых особенностей растения. Некоторые сорта в раннем возрасте хорошо переносят деление, другие же могут притормозить в своём развитии и в течение 1-2 лет практически не развиваться. Особенно это касается молодых растений, размноженных методом «InVitro».
Как делить хосту
Лучшие сроки для деления кустов хост – весна и конец лета. Впрочем, опытные цветоводы делят хосты практически в течение всего сезона.
Осеннее деление куста хосты
Весной, как только появятся молодые побеги, хосту выкапывают и делят при помощи лопаты, острого ножа или двух вил, воткнутых в середину куста «спина к спине». Вилы вначале сводят, взявшись за ручки, а потом раздвигают как можно шире, при этом корневая система травмируется меньше, чем при разрезании куста лопатой или ножом.
Деление куста хосты
Можно также не выкапывать куст целиком, а отделить от него часть в виде треугольного куска, острая часть которого направлена наружу, а не в центр. Образовавшуюся пустоту в маточном кусте заполняют плодородной земляной смесью.
Черенкование хост
Часто при делении куста случайно отламываются или обрезаются побеги-розетки практически без корней, но с кусочком корневища – «пяточкой». Такой побег-черенок высаживают отдельно в парник или в тенистое место, под прозрачную пластиковую бутыль, где, как правило, розетка хосты укореняется в течение 2-4 недель.
Черенки «с пяточкой»
Для уменьшения испарения и быстрейшего укоренения листья у черенков рекомендуется обрезать на одну треть или даже наполовину. Обычно черенками размножают молодые кусты или срезают отдельные розетки с «пяточкой» у взрослых растений, не выкапывая хосты из земли.
Хоста с компактной (на фото слева) и длиннокорневищной (справа) корневой системой
Иногда это бывает трудно сделать, так как у некоторых сортов побеги растут очень плотно друг к другу, и срезать черенок удачно не всегда возможно. А вот у хост с длиннокорневищной системой это получается довольно просто. У таких функий побеги расположены рыхло, поэтому отделить черенок не составляет особого труда.
Почему не растет хоста, какого ухода ей не хватает?
Замедленный рост и нездоровый вид – это верный признак заболевания. А лучшее лечение любой болезни – это правильный регулярный уход. У здоровых кустов большая сопротивляемость разным неблагоприятным факторам. Старайтесь выращивать эти многолетники в тех местах, где утром есть солнечный свет и тень во второй половине дня. Хоста не любит крайностей – ни плотной тени, ни яркого солнца. Выращивайте ее во влажной, хорошо дренированной почве, не допуская полного пересыхания почвы.
Наиболее частые вредители многолетника – это мыши-полевки. Они любят как верхушки растения, так и их корни. Поэтому, если вы увидите рядом с ней норы, вы уже знаете ответ на вопрос – почему плохо растет хоста?
Держите полевок вдали от ваших хост, тщательно пропалывая клумбы от сорняков сорняков, поскольку они привлекают мышей. Установите возле нее защитный бордюр из проволоки, чтобы полевкам было сложнее добраться до растения. Сделайте его как минимум на 20 см в высоту и примерно на 15 см ниже уровня земли, чтобы полевки не рыли норы у вас на клумбе. Посмотрите, как оживает защищенный от мышей куст за год:
Еще одна проблема — это вирусные заболевания, которые проявляются в виде крошечных пятен и искажений листьев. С этими вирусными заболеваниями трудно справиться, эффективных химических средств борьбы нет. Тем не менее, у вас есть некоторые рычаги, чтобы управлять этой ситуацией. Покупайте многолетники из надежных источников. Регулярно дезинфицируйте свой садовый инвентарь. Для уже зараженных кустов вариант состоит в их удалении и уничтожении.
Хоста является основой тенистого сада — она создает великолепные текстуры и формы, отлично сочетаясь с папоротниками, астильбой, гортензией и другими неприхотливыми многолетниками для тенистых участков сада.
Они украсят северную сторону дома и пространство под большими деревьями, места под забором и в узких тенистых проходах.
Сорта хост радуют своим разнообразием и красотой.
В самых темных уголках вашего дачного участка эти многолетники будут расти и процветать, если вы выделите для них богатую, рыхлую, влажную почву и обеспечите им минимальный уход.
Тогда, можете быть уверены, — хоста порадует вас своим великолепным видом ещё не один год.
Представить современный сад без хост практически невозможно, особенно если необходимо оформить тенистый уголок. Без декоративнолиственных растений невозможно создать красивую клумбу, ведь они обеспечивают необходимый фон для более ярких цветков, заполняют промежутки. Но хоста не просто фоновое растение, она будет эффектно смотреться и в одиночной посадке. Растение декоративно с момента распускания листьев и до первых заморозков.
Болезни и вредители
Наибольший вред хостам наносят слизни и улитки, поедая листву и оставляя дырочки на листьях. Для борьбы с ними раскладывают приманки.
Нематода листовая – в июле-августе на листьях между жилками появляются коричневые полоски. Из болезней наиболее распространена серая гниль. Вначале загнивают кончики листьев, а затем весь лист. Больные растения обрабатывают специальными препаратами.
В последние годы отмечаются вирусные заболевания хост с неравномерной пестролистностью, желтыми пятнами или крапинами на листьях. Такие растения лучше убирать с участка.
Три способа размножения хост
Добавить в избранноеХоста – теневыносливое неприхотливое растение, которое сегодня находится на пике популярности. Его декоративная листва хорошо впишется в любую композицию и сделает сад запоминающимся. У тех, кто заинтересовался хостами, часто возникает вопрос о способах её размножения. Сегодня мы поможем вам в этом разобраться.
ПоказатьСкрытьСуществует три способа размножения:
- семенами;
- делением куста;
- черенкованием.
Размножение семенами
Недостатком этого способа является невысокая всхожесть семян. Для её улучшения часто используют метод холодной стратификации. На пакетиках с покупными семенами, как правило, это указывается.
Стратификацию семян проводят и в естественных условиях. Для лучшей закалки растения семена помещают под снег.
Для проращивания рекомендуют использовать магазинный субстрат (меньше шансов на появление грибковых заболеваний и прочих микробов). В нём обязательно должны присутствовать торф, перлит и вермикулит. Если будет использоваться грунт из сада, то его необходимо полить концентрированным раствором марганцовки. Используют и стимуляторы роста, в которых замачивают семена.
Перед посадкой также следует хорошо обработать дренаж и контейнер. Для этих целей подойдёт медицинский спирт. После того, как семена хосты будут распределены на поверхности, их присыпают слоем земли (5-7 мм), уплотняют, хорошо поливают и накрывают плёнкой. Не забывайте следить за температурой. Она должна быть +18°С…+25°C. Первые всходы дадут о себе знать через две – три недели. Умеренный полив, защита от прямых солнечных лучей, своевременное удаление конденсата – всё, что нужно в этот период.
При появлении первых листочков проводят пикировку для того, чтобы сеянцы получились крупными и крепкими. Их берут вместе с комом земли и пересаживают в отдельную ёмкость, обильно поливая. Когда заморозки уже не ожидаются и грунт прогреется, можно высаживать в сад. Такой способ размножения считается трудоёмким.
Размножение делением куста
Таким способом лучше размножать сортовые хосты. Выкопанный целиком куст (4-5 лет), при помощи острого ножа или лопаты аккуратно разрезают на несколько частей. Места среза присыпают активированным или древесным углём, высаживают в подготовленные места.
Если необходимо получить большое количество растений, куст замачивают в воде, а потом аккуратно разбирают на отдельные розетки с листвой (не менее пары). Высаживают на определённую глубину (определяется глубиной произрастания материнского растения). Интервал между розетками должен составлять около 30 см. На протяжении нескольких недель следят за тем, чтобы почва была хорошо увлажнена.
Самым лучшим временем для размножения таким способом является май – сентябрь. Когда не удаётся выкопать куст целиком, можно отрезать розетки с края куста. Уберите часть земли в сторону и ощупайте пальцами её основание. Если корни сформированы, отделите эту часть при помощи острого садового инструмента. Высадить её необходимо на разводочное место. Через 1-2 года можно высаживать на постоянное.
Размножение черенкованием
Для такого способа размножения понадобится побег с листвой и «пяткой» (кусочек корневища). У черенка необходимо срезать верхнюю часть листьев (1/3 часть). Влага не так будет испаряться и растение быстрее укоренится.
После такой процедуры черенки можно высаживать в грунт или контейнер на глубину около 5 см. Хорошо полить и прикрыть наземную часть с помощью пластикового колпака. Периодически растение следует открывать. Хоста начинает болеть спустя несколько дней, но это нормальный процесс, скоро всё приходит в норму.
Способов несколько, но какой самый удобный – решать вам.
Воспроизведение: Паразиты выбирают лучшее из обоих миров
Большинство популяций животных производят генетически различное потомство посредством полового размножения. Однако незначительное меньшинство животных использует бесполое размножение для получения потомства, генетически идентичного родителю. Обе стратегии имеют свои преимущества и недостатки, и некоторые животные фактически чередуют половое и бесполое размножение (Decaestecker et al., 2009).
Большинство паразитов размножаются бесполым путем, но они могут переключиться на половое размножение, чтобы способствовать разнообразию и оставаться заразными.Некоторые виды паразитов могут даже размножаться половым путем с другими видами посредством процесса, называемого гибридизацией. Например, некоторые плоские шистосомные черви могут инфицировать более широкий круг хозяев в результате спаривания видов, заражающих крупного рогатого скота, с видами, инфицированными людьми (Huyse et al., 2009). Это демонстрирует, как вариации, вызванные гибридизацией, могут увеличивать распространение болезни.
Другим паразитом, размножающимся как половым, так и бесполым путем, является гриб Podosphaera plantaginis , который обычно поражает виды растений Plantago lanceolata , широко известные как подорожник обыкновенный (рис. 1).Эти грибы размножаются бесполым путем, производя инфекционные споры на протяжении всего своего жизненного цикла. Когда вегетационный период растения-хозяина подходит к концу, P. plantaginis производит покоящиеся споры, которые могут пережить зиму. Эти споры могут образовываться либо путем спаривания, либо посредством бесполого процесса, известного как гаплоидное самоопыление, при котором споры одного и того же организма «спариваются» друг с другом (Tollenaere and Laine, 2013; Рисунок 1). Однако половое размножение обходится гораздо дороже, что ставит под вопрос, почему патогены продолжают поддерживать эту репродуктивную стратегию.
Упрощенный жизненный цикл гриба
P. plantaginis.Гриб P. plantaginis может размножаться как бесполым (слева), так и половым (справа) способом. В течение вегетационного периода P. plantaginis заражает своего хозяина путем бесполого размножения генетически идентичных клональных спор (показаны пунктирной линией).Когда вегетационный период растения-хозяина подходит к концу, у P. plantaginis образуется плодовое тело, известное как хасмотеции, которое содержит покоящиеся споры, которые могут пережить зиму: они могут быть воспроизведены бесполым путем с помощью процесса, известного как гаплоидное самоопыление (слева). ) или половым путем посредством спаривания (справа). Когда начинается следующий вегетационный период, паразиты могут снова появиться из этих покоящихся спор и заразить хозяина.
Изображение предоставлено: Lore Bulteel (CC BY 4.0).
Одно из возможных объяснений исходит из эволюционной теории, известной как гипотеза Красной Королевы.Виды-хозяева и паразиты постоянно развиваются вместе, чтобы побеждать друг друга: хозяева совместно развивают повышенную сопротивляемость, в то время как паразиты увеличивают свою способность заражать. Гипотеза Красной Королевы предполагает, что хозяева с совместно развивающимся паразитом с большей вероятностью будут размножаться половым путем, чтобы увеличить генетическую изменчивость в своем потомстве, чтобы у них был больше шансов избежать заражения. Затем паразиты могут быстро и непрерывно развиваться в ответ на продолжающуюся эволюцию защиты хозяина.Таким образом, эта гонка вооружений паразит-хозяин предлагает эволюционное преимущество, помогая поддерживать генетическую изменчивость в популяции (Koskella, Lively, 2009; Decaestecker and King, 2019).
Временной лаг в коэволюции между этими двумя организмами во многом зависит от эволюционного потенциала (способности генетически адаптироваться в ответ на давление окружающей среды) паразита (Gandon et al., 2008). Однако большая часть доказательств, подтверждающих гипотезу Красной Королевы, поступила от популяций хозяев, а эволюционные и экологические преимущества полового размножения у паразитов почти не описаны.Теперь в eLife Юкка П Сирен из Университета Аалто и его сотрудники из Университета Хельсинки, Цюрихского и Лионского университетов, в том числе Анна-Лийза Лайне в качестве первого автора, сообщают о доказательствах сохранения полового размножения в субпопуляциях грибкового паразита . P. plantaginis (Laine et al., 2019).
Laine et al. отслеживали жизненный цикл субпопуляций P. plantaginis на Аландских островах Финляндии в течение четырех лет подряд. Анализ последовательностей ДНК каждых P.plantaginis показал, что каждый год вырабатывается ряд новых генотипов, что позволяет предположить, что половое размножение является обычным явлением для этого вида грибов. Для полового размножения по крайней мере два генотипически разных паразита должны заразить одного и того же хозяина, чтобы они могли находиться достаточно близко для обмена генетическим материалом. Laine et al. показал, что количество коинфицированных образцов варьировалось в зависимости от популяции. P. plantaginis с повышенным числом сопутствующих инфекций также обнаружил большее количество новых генотипов, что свидетельствует о наличии локализованных горячих точек генетического разнообразия.
Дальнейшая работа показала, что эти популяции с более высокой распространенностью сопутствующих инфекций (и, следовательно, полового размножения) также с большей вероятностью пережили зиму и инициировали инфекцию в следующем сезоне. Этот более высокий успех указывает на то, что эти вновь созданные генотипы могут дать начало популяциям, которые лучше приспособлены к заражению растения-хозяина. Когда начинается вегетационный период, это, в свою очередь, может повлиять на популяцию хозяев и заставить их адаптироваться к более высокому сопротивлению.
Субпопуляции хозяев и паразитов будут совместно эволюционировать с разной скоростью в зависимости от окружающей среды: например, в одном месте паразит может быть впереди в эволюционной гонке вооружений, в то время как в другом хозяин побеждает.Эти различия в скорости эволюции затем отражаются в пространстве, создавая локализованные очаги возникающих новых генотипов (Thompson, 2005). Увеличивая генетическое разнообразие в этих областях, паразиты могут «ограничивать свои эволюционные ставки» и создавать редкие генотипы, которые имеют более низкую приспособленность, но потенциально могут процветать в определенных стрессовых условиях окружающей среды (Starrfelt and Kokko, 2012). Поэтому было бы интересно изучить, как изменения давления отбора между P. plantaginis и его хозяином влияют на количество покоящихся спор, которые продуцируются половым путем.Этого можно достичь, создав банк из покоящихся спор P. plantaginis и отслеживая их инфекции на протяжении многих лет, чтобы увидеть, как они связаны с эволюционными изменениями (Gaba and Ebert, 2009).
Задачи будущего заключаются в том, чтобы увидеть, могут ли результаты, полученные в этом исследовании, быть воспроизведены в лабораторных экспериментах, и выявить возможные факторы избирательного давления и преимущества полового размножения у паразитов. Также возможно, что генетические изменения паразитов, генерируемые половым путем, могут влиять на важные экологические процессы: например, генетическая изменчивость паразитов может изменить форму хозяина, которая затем распространяется по популяции и разрушает всю экосистему.Эти изменения в экосистеме могут затем подпитывать эволюционные изменения паразита, приводя к полной обратной связи эко-коэволюционных взаимодействий.
Репликация вирусов | Британское общество иммунологии
Поскольку вирусы являются облигатными внутриклеточными патогенами, они не могут размножаться без механизмов и метаболизма клетки-хозяина. Хотя репликационный жизненный цикл вирусов сильно различается в зависимости от вида и категории вируса, существует шесть основных стадий, которые необходимы для репликации вируса.
1. Приложение: Вирусные белки на капсиде или фосфолипидной оболочке взаимодействуют со специфическими рецепторами на поверхности клетки хозяина. Эта специфичность определяет диапазон хозяев ( тропизм ) вируса.
2. Проникновение: Процесс прикрепления к определенному рецептору может вызвать конформационные изменения в белках вирусного капсида или липидной оболочке, что приводит к слиянию вирусной и клеточной мембран. Некоторые ДНК-вирусы также могут проникать в клетку-хозяина посредством рецепторно-опосредованного эндоцитоза.
3. Без покрытия: Вирусный капсид удаляется и разрушается вирусными ферментами или ферментами хозяина, высвобождающими вирусную геномную нуклеиновую кислоту.
4. Репликация: После того, как вирусный геном не покрыт оболочкой, начинается транскрипция или трансляция вирусного генома. Именно эта стадия вирусной репликации сильно различается между ДНК и РНК-вирусами и вирусами с противоположной полярностью нуклеиновых кислот. Этот процесс завершается синтезом de novo вирусных белков и генома.
5. Сборка: После de novo синтеза вирусного генома и белков, которые могут быть посттрансципционально модифицированы, вирусные белки упаковываются с вновь реплицированным вирусным геномом в новые вирионы, которые готовы к высвобождению из клетки-хозяина. Этот процесс также можно назвать созреванием.
6. Высвобождение вириона: Существует два метода высвобождения вируса: лизис или отпочкование . Лизис приводит к гибели инфицированной клетки-хозяина, эти типы вирусов обозначаются как cytolytic .Примером является оспа крупная , также известная как натуральная оспа. Оболочечные вирусы, такие как вирус гриппа А, обычно высвобождаются из клетки-хозяина путем отпочкования. Именно этот процесс приводит к приобретению вирусной фосфолипидной оболочки. Эти типы вирусов обычно не убивают инфицированную клетку и называются цитопатическими вирусами .
После высвобождения вириона некоторые вирусные белки остаются внутри клеточной мембраны хозяина, которая действует как потенциальные мишени для циркулирующих антител.Остаточные вирусные белки, которые остаются в цитоплазме клетки-хозяина, могут обрабатываться и представляться на поверхности клетки на молекулах MHC класса I, где они распознаются Т-клетками.
Репликация вируса © Авторские права на эту работу принадлежат автору
вирусных инфекций и хостов | Безграничная биология
Шаги вирусных инфекций
Вирусная инфекция включает внедрение вирусной ДНК в клетку-хозяин, репликацию этого материала и высвобождение новых вирусов.
Цели обучения
Перечислите этапы репликации вируса и объясните, что происходит на каждом этапе.
Основные выводы
Ключевые моменты
- Репликация вируса включает шесть этапов: прикрепление, проникновение, снятие покрытия, репликация, сборка и высвобождение.
- Во время прикрепления и проникновения вирус прикрепляется к клетке-хозяину и внедряет в нее свой генетический материал.
- Во время удаления оболочки, репликации и сборки вирусная ДНК или РНК встраивается в генетический материал клетки-хозяина и побуждает его реплицировать вирусный геном.
- Во время высвобождения вновь созданные вирусы высвобождаются из клетки-хозяина, либо заставляя клетку распадаться, ожидая ее смерти, либо отпочковываясь через клеточную мембрану.
Ключевые термины
- вирион : отдельная индивидуальная частица вируса (вирусный эквивалент клетки)
- гликопротеин : белок с ковалентно связанными углеводами
- ретровирус : вирус, геном которого состоит из РНК.
Шаги вирусных инфекций
Вирус должен использовать клеточные процессы для размножения.Цикл репликации вируса может вызвать драматические биохимические и структурные изменения в клетке-хозяине, которые могут вызвать повреждение клетки. Эти изменения, называемые цитопатическими (вызывающими повреждение клеток) эффектами, могут изменять функции клеток или даже разрушать их. Некоторые инфицированные клетки, например инфицированные вирусом простуды, известным как риновирус, умирают в результате лизиса (разрыва) или апоптоза (запрограммированной гибели клеток или «клеточного самоубийства»), высвобождая все дочерние вирионы сразу. Симптомы вирусных заболеваний возникают в результате иммунного ответа на вирус, который пытается контролировать и уничтожать вирус из организма, а также в результате повреждения клеток, вызванного вирусом.Многие вирусы животных, такие как ВИЧ (вирус иммунодефицита человека), покидают инфицированные клетки иммунной системы в результате процесса, известного как почкование, когда вирионы покидают клетку по отдельности. В процессе бутонизации клетка не подвергается лизису и не погибает сразу. Однако повреждение клеток, которые заражает вирус, может сделать невозможным нормальное функционирование клеток, даже если клетки остаются живыми в течение определенного периода времени. Большинство продуктивных вирусных инфекций проходят аналогичные шаги в цикле репликации вируса: прикрепление, проникновение, снятие оболочки, репликация, сборка и высвобождение.
Путь к вирусной инфекции : При инфекции вирусом гриппа гликопротеины прикрепляются к эпителиальной клетке хозяина. В результате вирус охвачен. РНК и белки производятся и собираются в новые вирионы.
Приложение
Вирус прикрепляется к конкретному рецепторному участку на мембране клетки-хозяина через белки прикрепления в капсиде или через гликопротеины, встроенные в оболочку вируса. Специфичность этого взаимодействия определяет хозяина (и клетки внутри хозяина), которые могут быть инфицированы определенным вирусом.Это можно проиллюстрировать, подумав о нескольких ключах и нескольких замках, где каждый ключ подходит только для одного конкретного замка.
Запись
Нуклеиновая кислота бактериофагов проникает в клетку-хозяина голой, оставляя капсид вне клетки. Вирусы растений и животных могут проникать через эндоцитоз, при котором клеточная мембрана окружает и поглощает весь вирус. Некоторые вирусы в оболочке попадают в клетку, когда вирусная оболочка сливается непосредственно с клеточной мембраной. Попав внутрь клетки, вирусный капсид разрушается, и высвобождается вирусная нуклеиновая кислота, которая затем становится доступной для репликации и транскрипции.
Репликация и сборка
Механизм репликации зависит от вирусного генома. ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для создания дополнительной ДНК, которая транскрибируется в информационную РНК (мРНК), которая затем используется для управления синтезом белка. РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков, а также на сборку новых вирионов. Конечно, из этого правила есть исключения.Если клетка-хозяин не обеспечивает ферментов, необходимых для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза недостающих белков. Ретровирусы, такие как ВИЧ, имеют геном РНК, который должен быть подвергнут обратной транскрипции в ДНК, которая затем встраивается в геном клетки-хозяина.
Для преобразования РНК в ДНК ретровирусы должны содержать гены, кодирующие вирус-специфический фермент обратной транскриптазы, который транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках-хозяевах; необходимый фермент, обратная транскриптаза, происходит только в результате экспрессии вирусных генов в инфицированных клетках-хозяевах.Тот факт, что ВИЧ вырабатывает некоторые из собственных ферментов, которых нет у хозяина, позволил исследователям разработать препараты, ингибирующие эти ферменты. Эти препараты, включая ингибитор обратной транскриптазы AZT, подавляют репликацию ВИЧ, снижая активность фермента, не влияя на метаболизм хозяина. Этот подход привел к разработке множества лекарств, используемых для лечения ВИЧ, и оказался эффективным в снижении количества инфекционных вирионов (копий вирусной РНК) в крови до необнаруживаемых уровней у многих ВИЧ-инфицированных людей.
Выход
Последним этапом репликации вируса является высвобождение новых вирионов, продуцируемых в организме хозяина. Затем они могут инфицировать соседние клетки и повторять цикл репликации. Как вы узнали, некоторые вирусы высвобождаются, когда клетка-хозяин умирает, в то время как другие вирусы могут покидать инфицированные клетки, прорастая через мембрану, не убивая непосредственно клетку.
Литический и лизогенный циклы бактериофагов
Бактериофаги, вирусы, поражающие бактерии, могут подвергаться литическому или лизогенному циклу.
Цели обучения
Описать литический и лизогенный циклы бактериофагов
Основные выводы
Ключевые моменты
- Вирусы видоспецифичны, но почти все виды на Земле могут быть поражены той или иной формой вируса.
- Литический цикл включает воспроизводство вирусов с использованием клетки-хозяина для производства большего количества вирусов; затем вирусы вырываются из клетки.
- Лизогенный цикл включает включение вирусного генома в геном клетки-хозяина, заражение его изнутри.
Ключевые термины
- латентность : способность патогенного вируса находиться в состоянии покоя внутри клетки.
- бактериофаг : вирус, специфически поражающий бактерии.
- литический цикл : нормальный процесс размножения вируса, включающий проникновение через клеточную мембрану, синтез нуклеиновых кислот и лизис клетки-хозяина.
- лизогенный цикл : форма вирусной репродукции, включающая слияние нуклеиновой кислоты бактериофага с нуклеиновой кислотой хозяина с последующей пролиферацией образовавшегося профага.
Разные хосты и их вирусы
Вирусы часто очень специфичны в отношении того, какие хозяева и какие клетки внутри хозяина они заразят. Эта особенность вируса делает его специфичным для одного или нескольких видов жизни на Земле. Существует так много разных типов вирусов, что почти у каждого живого организма есть свой набор вирусов, которые пытаются заразить его клетки. Даже самые маленькие и простые клетки, прокариотические бактерии, могут быть атакованы определенными типами вирусов.
Бактериофаг : Эта микрофотография, полученная с помощью просвечивающего электронного микроскопа, показывает бактериофаги, прикрепленные к бактериальной клетке.
Бактериофаги
Бактериофаги – это вирусы, поражающие бактерии. Бактериофаги могут иметь литический или лизогенный цикл, и некоторые вирусы способны выполнять и то, и другое. Когда инфицирование клетки бактериофагом приводит к образованию новых вирионов, инфекция считается продуктивной.
Литический цикл в сравнении с лизогенным циклом : Бактериофаг умеренного климата имеет как литический, так и лизогенный циклы. В литическом цикле фаг реплицирует и лизирует хозяйскую клетку.В лизогенном цикле фаговая ДНК включается в геном хозяина, где передается последующим поколениям. Стрессовые факторы окружающей среды, такие как голод или воздействие токсичных химикатов, могут вызвать вырезание профага и его включение в литический цикл.
Литический цикл
С помощью литических фагов бактериальные клетки вскрываются (лизируются) и разрушаются после немедленной репликации вириона. Как только клетка разрушается, потомство фага может найти новых хозяев для заражения. Примером литического бактериофага является Т4, который заражает E.coli , обнаруженная в кишечном тракте человека. Литические фаги больше подходят для фаговой терапии.
Некоторые литические фаги подвергаются феномену, известному как ингибирование лизиса, когда законченное фаговое потомство не будет немедленно лизироваться из клетки, если внеклеточные концентрации фага высоки.
Лизогенный цикл
Напротив, лизогенный цикл не приводит к немедленному лизису клетки-хозяина. Фаги, способные подвергаться лизогению, известны как фаги умеренного климата. Их вирусный геном будет интегрироваться с ДНК хозяина и реплицироваться вместе с ним довольно безвредно или даже может стать плазмидой.Вирус остается бездействующим до тех пор, пока условия для хозяина не ухудшатся, возможно, из-за истощения питательных веществ; затем становятся активными эндогенные фаги (известные как профаги). В этот момент они запускают репродуктивный цикл, что приводит к лизису клетки-хозяина. Поскольку лизогенный цикл позволяет клетке-хозяину продолжать выживать и воспроизводиться, вирус воспроизводится во всем потомстве клетки. Примером бактериофага, который, как известно, следует лизогенному циклу и литическому циклу, является лямбда фага E.coli.
Период задержки
Вирусы, поражающие клетки растений или животных, также могут подвергаться инфекциям, когда они не продуцируют вирионы в течение длительного времени. Примером являются вирусы герпеса животных, включая вирусы простого герпеса, которые вызывают у людей оральный и генитальный герпес. В процессе, называемом латентным, эти вирусы могут существовать в нервной ткани в течение длительных периодов времени, не производя новых вирионов, только чтобы периодически оставлять латентный период и вызывать поражения кожи, где реплицируется вирус.Несмотря на то, что есть сходство между лизогенией и латентностью, термин лизогенный цикл обычно используется для описания бактериофагов.
Вирусы животных
Генетический материал вирусов животных копируется клеткой-хозяином, после чего они попадают в окружающую среду и вызывают заболевание.
Цели обучения
Описать различные вирусы животных и вызываемые ими болезни
Основные выводы
Ключевые моменты
- Вирусы животных могут проникать в клетку-хозяина либо посредством рецептор-опосредованного эндоцитоза, либо путем изменения формы и проникновения в клетку через клеточную мембрану.
- Вирусы вызывают заболевания людей и других животных; им часто приходится идти своим чередом, прежде чем симптомы исчезнут.
- Примеры вирусных болезней животных включают гепатит С, ветряную оспу и опоясывающий лишай.
Ключевые термины
- рецептор-опосредованный эндоцитоз : процесс, с помощью которого клетки интернализуют молекулы (эндоцитоз) за счет отрастания внутрь пузырьков плазматической мембраны, содержащих белки с рецепторными участками, специфичными для интернализуемых молекул
Вирусы животных
Вирусы животных, в отличие от вирусов растений и бактерий, не должны проникать через клеточную стенку, чтобы получить доступ к клетке-хозяину.Вирусы животных без оболочки или «голые» вирусы могут проникать в клетки двумя разными способами. Когда белок в вирусном капсиде связывается со своим рецептором в клетке-хозяине, вирус может попадать внутрь клетки через везикулу во время нормального клеточного процесса рецептор-опосредованного эндоцитоза. Альтернативный метод проникновения в клетки, используемый вирусами без оболочки, заключается в том, что капсидные белки претерпевают изменения формы после связывания с рецептором, создавая каналы в мембране клетки-хозяина. Затем вирусный геном «вводится» в клетку-хозяин через эти каналы аналогично тому, как это используется многими бактериофагами.Оболочечные вирусы также имеют два пути проникновения в клетки после связывания со своими рецепторами: рецептор-опосредованный эндоцитоз и слияние. Многие вирусы в оболочке проникают в клетку посредством рецепторно-опосредованного эндоцитоза аналогично некоторым вирусам без оболочки. С другой стороны, слияние происходит только с вирионами с оболочкой. Эти вирусы, в том числе ВИЧ, используют в своих оболочках специальные слитые белки, чтобы заставить оболочку слиться с плазматической мембраной клетки, высвобождая таким образом геном и капсид вируса в цитоплазму клетки.
После создания своих белков и копирования своих геномов вирусы животных завершают сборку новых вирионов и покидают клетку. Используя пример ВИЧ, вирусы животных в оболочке могут отпочковываться от клеточной мембраны по мере их сборки, захватывая при этом часть плазматической мембраны клетки. С другой стороны, вирусное потомство без оболочки, такое как риновирусы, накапливается в инфицированных клетках до тех пор, пока не появится сигнал для лизиса или апоптоза, и все вирионы высвободятся вместе.
Вирусы животных связаны с различными заболеваниями человека.Некоторые из них развиваются по классической схеме острого заболевания, когда симптомы ухудшаются на короткий период, после чего иммунная система выводит вирус из организма с возможным выздоровлением от инфекции. Примеры острых вирусных заболеваний – простуда и грипп. Другие вирусы вызывают длительные хронические инфекции, такие как вирус, вызывающий гепатит С, тогда как другие, такие как вирус простого герпеса, вызывают только периодические симптомы. Еще другие вирусы, такие как вирусы герпеса человека 6 и 7, которые в некоторых случаях могут вызывать легкую детскую болезнь розеолу, часто успешно вызывают продуктивные инфекции, не вызывая никаких симптомов у хозяина; у этих пациентов инфекция протекает бессимптомно.
При инфекциях гепатита С вирус растет и размножается в клетках печени, вызывая незначительные повреждения печени. Ущерб настолько низок, что инфицированные люди часто не подозревают о том, что они инфицированы, при этом многие инфекции выявляются только при рутинном анализе крови пациентов с такими факторами риска, как внутривенное употребление наркотиков. Поскольку многие симптомы вирусных заболеваний вызваны иммунными реакциями, отсутствие симптомов указывает на слабый иммунный ответ на вирус. Это позволяет вирусу избежать элиминации иммунной системой и сохраняться у людей в течение многих лет, продолжая при этом производить низкие уровни потомства вирионов при так называемом хроническом вирусном заболевании.Хроническая инфекция печени этим вирусом приводит к гораздо большей вероятности развития рака печени, иногда через 30 лет после первоначального заражения.
Как уже упоминалось, вирус простого герпеса может оставаться в латентном состоянии в нервной ткани в течение месяцев и даже лет. Поскольку вирус «прячется» в ткани и производит мало вирусных белков, если вообще производит их, иммунному ответу не против чего действовать; иммунитет к вирусу постепенно снижается. При определенных условиях, включая различные типы физического и психологического стресса, латентный вирус простого герпеса может реактивироваться и подвергаться литическому циклу репликации в коже, вызывая поражения, связанные с заболеванием.После того, как в коже образуются вирионы и синтезируются вирусные белки, иммунный ответ снова стимулируется и устраняет поражения кожи за несколько дней, уничтожая вирусы в коже. В результате этого типа репликативного цикла появление герпеса и вспышек генитального герпеса происходит только периодически, хотя вирусы остаются в нервной ткани на всю жизнь. Скрытые инфекции распространены также и с другими вирусами герпеса, включая вирус ветряной оспы, вызывающий ветряную оспу.После перенесенной в детстве инфекции ветряной оспы вирус ветряной оспы может оставаться латентным в течение многих лет и повторно активироваться у взрослых, вызывая болезненное состояние, известное как «опоясывающий лишай».
Вирус ветряной оспы : (a) Varicella-zoster, вирус, вызывающий ветряную оспу, имеет покрытый оболочкой икосаэдрический капсид, видимый на этой просвечивающей электронной микрофотографии. Его геном двухцепочечной ДНК встраивается в ДНК хозяина и реактивируется после латентного периода в виде (b) опоясывающего лишая, часто с сыпью.
Вирусы растений
Вирусы растений могут вызывать повреждение стеблей, листьев и плодов и могут оказать серьезное влияние на экономику из-за перебоев в снабжении продовольствием.
Цели обучения
Приведите примеры вирусов растений и объясните, почему они могут быть дорогостоящими для экономики
Основные выводы
Ключевые моменты
- У растений есть клеточные стенки, которые защищают их от проникновения вирусов в их клетки, поэтому для того, чтобы они могли заразиться, должно произойти какое-то повреждение.
- Когда вирусы передаются между растениями, это называется горизонтальной передачей; когда они передаются от родительского растения к потомству, это называется вертикальной передачей.
- Симптомы заражения растительным вирусом включают деформированные листья, черные полосы на стеблях, обесцвечивание листьев и плодов, а также кольцевые пятна.
- Вирусы растений могут вызвать серьезные нарушения роста сельскохозяйственных культур, что, в свою очередь, может оказать серьезное влияние на экономику.
Ключевые термины
- горизонтальная передача : передача инфекционного агента, такого как бактериальная, грибковая или вирусная инфекция, между представителями одного и того же вида, не состоящими в отношениях между родителями и детьми
- вертикальная передача : передача инфекции или другого заболевания от самки вида к потомству
Вирусы растений
Вирусы растений, как и другие вирусы, содержат ядро из ДНК или РНК.Поскольку вирусы растений имеют клеточную стенку для защиты своих клеток, их вирусы не используют рецептор-опосредованный эндоцитоз для проникновения в клетки-хозяева, как это наблюдается с вирусами животных. Для того чтобы многие вирусы растений передавались от растения к растению, должно произойти повреждение некоторых клеток растений, чтобы вирус мог проникнуть к новому хозяину. Этот ущерб часто вызван погодой, насекомыми, животными, огнем или деятельностью человека, например, сельским хозяйством или ландшафтным дизайном. Кроме того, потомство растений может унаследовать вирусные заболевания от родительских растений.
Вирусы растений могут передаваться различными переносчиками: через контакт с соком инфицированного растения, через живые организмы, такие как насекомые и нематоды, а также через пыльцу. Когда вирусы растений передаются между разными растениями, это называется горизонтальной передачей; когда они унаследованы от родителя, это называется вертикальной передачей.
Симптомы вирусных заболеваний различаются в зависимости от вируса и его хозяина. Одним из распространенных симптомов является гиперплазия: аномальное разрастание клеток, вызывающее появление опухолей растений, известных как галлы.Другие вирусы вызывают гипоплазию или снижение роста клеток в листьях растений, вызывая появление тонких желтых участков. Тем не менее, другие вирусы воздействуют на растения, непосредственно убивая растительные клетки; процесс, известный как некроз клеток. Другие симптомы вирусов растений включают деформированные листья, черные полосы на стеблях растений, нарушение роста стеблей, листьев или плодов и кольцевые пятна, которые представляют собой круглые или линейные участки обесцвечивания, обнаруживаемые на листе.
Галлы дуба : Галлы – это аномальный рост растений или опухоли, образованные растительной тканью.Галлы обычно встречаются на листве или ветках. Эти необычные деформации вызваны химическими веществами, регулирующими рост растений, или стимулами, производимыми насекомыми или другими видами членистоногих-вредителей. Химические вещества, производимые этими возбудителями, мешают нормальному росту растительных клеток.
Вирусы растений могут серьезно нарушить рост и развитие сельскохозяйственных культур, существенно влияя на наши продукты питания. Они несут ответственность за низкое качество и количество урожая во всем мире и могут ежегодно приводить к огромным экономическим потерям.Другие вирусы могут повредить растения, используемые в озеленении. Некоторые вирусы, поражающие сельскохозяйственные пищевые растения, включают название растения, которое они заражают, например вирус пятнистого увядания томатов, вирус общей мозаики фасоли и вирус мозаики огурца. В растениях, используемых для озеленения, два наиболее распространенных вируса – это вирус кольцевой пятнистости пиона и вирус мозаики роз. Слишком много вирусов растений, чтобы подробно обсуждать каждый, но симптомы вируса мозаики фасоли приводят к снижению продуктивности фасоли и к низкорослости и непродуктивности растений.У декоративных роз мозаичное заболевание роз вызывает волнистые желтые линии и цветные пятна на листьях растения.
вирусов | Национальное географическое общество
Вирусы – это крошечные инфекционные агенты, размножение которых зависит от живых клеток. Они могут использовать животное, растение или бактерию-хозяина для выживания и размножения. В связи с этим ведутся споры о том, следует ли считать вирусы живыми организмами. Вирус, находящийся за пределами клетки-хозяина, известен как вирион.
Вирусы не только микроскопичны, но и меньше многих других микробов, например бактерий. Большинство вирусов имеют диаметр всего 20–400 нанометров, тогда как яйцеклетки человека, например, имеют диаметр около 120 микрометров, а бактерии E. coli имеют диаметр около 1 микрометра. Вирусы настолько малы, что их лучше всего рассматривать с помощью электронного микроскопа, именно так они были впервые визуализированы в 1940-х годах.
Вирусы обычно бывают двух видов: стержни или сферы.Однако бактериофаги (вирусы, поражающие бактерии) имеют уникальную форму с геометрической головкой и нитевидными хвостовыми волокнами. Независимо от формы, все вирусы состоят из генетического материала (ДНК или РНК) и имеют внешнюю белковую оболочку, известную как капсид.
Есть два процесса, используемых вирусами для репликации: литический цикл и лизогенный цикл. Некоторые вирусы воспроизводятся с использованием обоих методов, в то время как другие используют только литический цикл. В литическом цикле вирус прикрепляется к клетке-хозяину и вводит ее ДНК.Используя клеточный метаболизм хозяина, вирусная ДНК начинает реплицироваться и образовывать белки. Затем собираются полностью сформированные вирусы. Эти вирусы разрушают или лизируют клетку и распространяются на другие клетки, чтобы продолжить цикл.
Как и в литическом цикле, в лизогенном цикле вирус прикрепляется к клетке-хозяину и вводит ее ДНК. Оттуда вирусная ДНК включается в ДНК хозяина и клетки хозяина. Каждый раз, когда клетки хозяина реплицируются, ДНК вируса также реплицируется, распространяя свою генетическую информацию по всему хозяину без необходимости лизировать инфицированные клетки.
У человека вирусы могут вызывать множество заболеваний. Например, грипп вызывается вирусом гриппа. Обычно вирусы вызывают у хозяина иммунный ответ, который убивает вирус. Однако некоторые вирусы, такие как вирус иммунодефицита человека или ВИЧ, не поддаются успешному лечению иммунной системой. Это приводит к более хронической инфекции, которую трудно или невозможно вылечить; часто лечить можно только симптомы.
В отличие от бактериальных инфекций, антибиотики неэффективны при лечении вирусных инфекций.Лучше всего предотвратить вирусные инфекции с помощью вакцин, хотя противовирусные препараты могут лечить некоторые вирусные инфекции. Большинство противовирусных препаратов действуют, препятствуя репликации вируса. Некоторые из этих препаратов останавливают синтез ДНК, предотвращая репликацию вируса
.Хотя вирусы могут иметь разрушительные последствия для здоровья, они также имеют важное технологическое применение. Вирусы особенно важны для генной терапии. Поскольку некоторые вирусы включают свою ДНК в ДНК хозяина, они могут быть генетически модифицированы, чтобы нести гены, которые принесут пользу хозяину.Некоторые вирусы можно даже спроектировать так, чтобы они воспроизводились в раковых клетках и заставляли иммунную систему убивать эти вредные клетки. Хотя это все еще развивающаяся область исследований, она дает вирусам возможность в один прекрасный день принести больше пользы, чем вреда.
Биология и репликация коронавируса: последствия для SARS-CoV-2
Исследовательская группа Coronaviridae Международного комитета по таксономии вирусов. Виды Коронавирус, связанный с тяжелым острым респираторным синдромом: классификация 2019-nCoV и присвоение ему названия SARS-CoV-2. Нац. Microbiol. 5 , 536–544 (2020). Последнее обновление таксономии коронавирусов Международным комитетом по таксономии вирусов после появления SARS-CoV-2. Придумал вирусное название SARS-CoV-2 .
Google ученый
Корман В. М., Мут Д., Нимейер Д. и Дростен К. Хозяева и источники эндемичных коронавирусов человека. Adv. Virus Res. 100 , 163–188 (2018).
CAS PubMed PubMed Central Google ученый
Горбаленя, А. Э., Энжуанес, Л., Зибур, Дж. И Снайдер, Э. Дж. Нидовиралес: эволюция генома крупнейшего РНК-вируса. Virus Res. 117 , 17–37 (2006).
CAS PubMed PubMed Central Google ученый
Перлман С. и Нетленд Дж. Коронавирусы после атипичной пневмонии: обновленная информация о репликации и патогенезе. Нац. Rev. Microbiol. 7 , 439–450 (2009).
CAS PubMed PubMed Central Google ученый
Мастерс П.С. Молекулярная биология коронавирусов. Adv. Virus Res. 65 , 193–292 (2006).
Google ученый
Лю Д. Х., Фунг Т. С., Чонг, К. К. Л., Шукла, А. и Хильгенфельд, Р. Дополнительные белки SARS-CoV и других коронавирусов. Антивирь. Res. 109 , 97–109 (2014).
CAS PubMed Google ученый
Schalk, A. & Hawn, M.C. Очевидно новое респираторное заболевание цыплят. J. Am. Вет. Med. Доц. 78 , 413–423 (1931).
Google ученый
Хамре, Д. и Прокоу, Дж. Дж. Новый вирус, выделенный из дыхательных путей человека. Proc. Soc. Exp. Биол. Med. 121 , 190–193 (1966).
CAS PubMed Google ученый
МакИнтош, К., Дис, Дж. Х., Беккер, В. Б., Капикян, А. З. и Чанок, Р. М. Извлечение в культурах трахеальных органов новых вирусов от пациентов с респираторными заболеваниями. Proc. Natl Acad. Sci. США 57 , 933–940 (1967).
CAS PubMed Google ученый
Торторичи, М. А. и Вислер, Д. Структурное понимание проникновения коронавируса. Adv. Virus Res. 105 , 93–116 (2019).
CAS PubMed PubMed Central Google ученый
Ли Ф. Структура, функция и эволюция шиповых белков коронавируса. Annu. Rev. Virol. 3 , 237–261 (2016).
CAS PubMed PubMed Central Google ученый
Летко М., Марци А. и Мюнстер В. Функциональная оценка входа в клетки и использования рецепторов для SARS-CoV-2 и других бета-коронавирусов линии B. Нац. Microbiol. 5 , 562–569 (2020). Первая функциональная оценка взаимодействия связывающего домена рецептора белка SARS-CoV-2 Spike с клеточным рецептором ACE2 .
CAS PubMed Google ученый
Li, W. et al. Ангиотензин-превращающий фермент 2 является функциональным рецептором коронавируса SARS. Природа 426 , 450–454 (2003).
CAS PubMed PubMed Central Google ученый
Zhou, P. et al. Вспышка пневмонии, связанная с новым коронавирусом, вероятно, происхождения летучих мышей. Природа 579 , 270–273 (2020).
CAS PubMed PubMed Central Google ученый
Hoffmann, M. et al.Вход в клетки SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Ячейка 181 , 271–280 (2020). Функциональная оценка проникновения SARS-CoV-2 в клетки-хозяева, подчеркивающая важность рецептора ACE2 и клеточной протеазы TMPRSS2 как факторов входа .
CAS PubMed PubMed Central Google ученый
Walls, A.C. et al. Структура, функция и антигенность гликопротеина шипа SARS-CoV-2. Ячейка 181 , 281–292 (2020). Рекомендуемый ресурс, описывающий ключевые аспекты функций SARS-CoV-2 Spike .
CAS PubMed PubMed Central Google ученый
Ли, Ф., Ли, У., Фарзан, М. и Харрисон, С. С. Структурная биология: структура домена связывания шипа коронавируса SARS с рецептором в комплексе с рецептором. Наука 309 , 1864–1868 (2005).
CAS PubMed Google ученый
Li, W. et al. Рецепторные и вирусные детерминанты адаптации SARS-коронавируса к человеческому ACE2. EMBO J. 24 , 1634–1643 (2005).
CAS PubMed PubMed Central Google ученый
Lan, J. et al. Структура спайк-связывающего домена SARS-CoV-2, связанного с рецептором ACE2. Природа https://doi.org/10.1038/s41586-020-2180-5 (2020).
Артикул PubMed PubMed Central Google ученый
Shang, J. et al. Структурные основы распознавания рецепторов SARS-CoV-2. Природа https://doi.org/10.1038/s41586-020-2179-y (2020).
Артикул PubMed PubMed Central Google ученый
Yan, R. et al. Структурная основа распознавания SARS-CoV-2 полноразмерным человеческим ACE2. Наука 367 , 1444–1448 (2020).
CAS PubMed PubMed Central Google ученый
Boni, M. F. et al. Эволюционное происхождение линии сарбековируса SARS-CoV-2, ответственной за пандемию COVID-19. Нац. Microbiol. https://doi.org/10.1038/s41564-020-0771-4 (2020).
Артикул PubMed Google ученый
Wu, F. et al. Новый коронавирус, связанный с респираторным заболеванием человека в Китае. Природа https://doi.org/10.1038/s41586-020-2008-3 (2020).
Артикул PubMed PubMed Central Google ученый
Gierer, S. et al. Спайковый белок появляющегося бета-коронавируса EMC использует новый рецептор коронавируса для входа, может быть активирован TMPRSS2 и нацелен на нейтрализующие антитела. J. Virol. 87 , 5502–5511 (2013).
CAS PubMed PubMed Central Google ученый
Matsuyama, S. et al. Эффективная активация спайк-белка коронавируса тяжелого острого респираторного синдрома трансмембранной протеазой TMPRSS2. J. Virol. 84 , 12658–12664 (2010).
CAS PubMed PubMed Central Google ученый
Simmons, G. et al. Ингибиторы катепсина L предотвращают проникновение коронавируса при тяжелом остром респираторном синдроме. Proc. Natl Acad. Sci. США 102 , 11876–11881 (2005).
CAS PubMed Google ученый
Belouzard, S., Чу, В. С. и Уиттакер, Г. Р. Активация белка шипа коронавируса SARS посредством последовательного протеолитического расщепления в двух разных сайтах. Proc. Natl Acad. Sci. США 106 , 5871–5876 (2009).
CAS PubMed Google ученый
Ou, X. et al. Характеристика спайкового гликопротеина SARS-CoV-2 при проникновении вируса и его иммунная перекрестная реактивность с SARS-CoV. Нац. Commun. 11 , 1620 (2020).
CAS PubMed PubMed Central Google ученый
Кавасе, М., Ширато, К., ван дер Хук, Л., Тагучи, Ф. и Мацуяма, С. Одновременная обработка клеток бронхиального эпителия человека ингибиторами серина и цистеиновых протеаз предотвращает тяжелый острый респираторный синдром. проникновение коронавируса. J. Virol. 86 , 6537–6545 (2012).
CAS PubMed PubMed Central Google ученый
Shang, J. et al. Механизмы входа в клетки SARS-CoV-2. Proc. Natl Acad. Sci. США 117 , 11727–11734 (2020).
CAS Google ученый
Yamamoto, M. et al. Идентификация нафамостата как мощного ингибитора ближневосточного респираторного синдрома Коронавирусное белок-опосредованное слияние мембран с использованием анализа клеточно-клеточного слияния на основе расщепленного белка. Антимикробный. Агенты Chemother. 60 , 6532–6539 (2016).
CAS PubMed PubMed Central Google ученый
Hoffmann, M. et al. Мезилат нафамостата блокирует активацию SARS-CoV-2: новый вариант лечения COVID-19. Антимикробный. Агенты Chemother. https://doi.org/10.1128/AAC.00754-20 (2020).
Артикул PubMed PubMed Central Google ученый
Hamming, I. et al. Распределение в тканях белка ACE2, функционального рецептора коронавируса SARS.Первый шаг к пониманию патогенеза SARS. J. Pathol. 203 , 631–637 (2004).
CAS PubMed PubMed Central Google ученый
Shieh, W. J. et al. Иммуногистохимия, гибридизация in situ и ультраструктурная локализация коронавируса, ассоциированного с SARS, в легких смертельного случая тяжелого острого респираторного синдрома на Тайване. Гум. Патол. 36 , 303–309 (2005).
PubMed PubMed Central Google ученый
Leung, G.M. et al. Эпидемиология тяжелого острого респираторного синдрома во время эпидемии в Гонконге 2003 года: анализ всех 1755 пациентов. Ann. Междунар. Med. 141 , 662–673 (2004).
PubMed Google ученый
Wölfel, R. et al. Вирусологическая оценка госпитализированных пациентов с COVID-2019. Природа https://doi.org/10.1038/s41586-020-2196-x (2020). Демонстрирует репликацию SARS-CoV-2 в верхних дыхательных путях и предоставляет подробный анализ производства и распространения вируса в течение COVID – 19 .
Артикул PubMed Google ученый
Ziegler, C.G.K. et al. Рецептор SARS-CoV-2 ACE2 представляет собой стимулируемый интерфероном ген в эпителиальных клетках дыхательных путей человека и обнаруживается в определенных подмножествах клеток в тканях. Ячейка 181 , 1016–1035 (2020).
CAS PubMed PubMed Central Google ученый
Blanco-Melo, D. et al. Несбалансированная реакция хозяина на SARS-CoV-2 способствует развитию COVID-19. Ячейка https://doi.org/10.1016/j.cell.2020.04.026 (2020).
Артикул PubMed PubMed Central Google ученый
Сигрист, К.Дж., Бридж А. и Ле Мерсье П. Потенциальная роль интегринов в проникновении в хозяйскую клетку SARS-CoV-2. Antiviral Res. https://doi.org/10.1016/j.antiviral.2020.104759 (2020).
Артикул PubMed PubMed Central Google ученый
Li, W. et al. Идентификация функции связывания сиаловой кислоты для гликопротеина шипа коронавируса ближневосточного респираторного синдрома. Proc. Natl Acad. Sci. США 114 , E8508 – E8517 (2017).
CAS PubMed Google ученый
de Haan, C. A. M. et al. Коронавирус мышей с расширенным диапазоном хозяев использует гепарансульфат в качестве рецептора проникновения. J. Virol. 79 , 14451–14456 (2005).
PubMed PubMed Central Google ученый
Cantuti-Castelvetri, L. et al. Нейропилин-1 облегчает проникновение в клетки SARS-CoV-2 и обеспечивает возможный путь в центральную нервную систему.Препринт на bioRxiv https://doi.org/10.1101/2020.06.07.137802 (2020).
Артикул Google ученый
Daly, J. L. et al. Нейропилин-1 является фактором хозяина для инфекции SARS-CoV-2. Препринт на bioRxiv https://doi.org/10.1101/2020.06.05.134114 (2020).
Артикул Google ученый
Menachery, V. D. et al. Лечение трипсином открывает барьер для заражения коронавирусом зоонозных летучих мышей. J. Virol. 94 , e01774–19 (2020). Подчеркивает требования к межвидовой передаче и зоонозный потенциал коронавирусов .
CAS PubMed PubMed Central Google ученый
Coutard, B. et al. Спайковый гликопротеин нового коронавируса 2019-nCoV содержит фурин-подобный сайт расщепления, отсутствующий в CoV той же клады. Антивирь. Res. 176 , 104742 (2020).
CAS PubMed Google ученый
Hoffmann, M., Kleine-Weber, K.-W. & Pöhlmann, S. Многоосновной сайт расщепления в спайковом белке SARS-CoV-2 необходим для инфицирования клеток легких человека. Мол. Ячейка 78 , 779–784.e5 (2020).
CAS PubMed PubMed Central Google ученый
Chan, C. M. et al. Спайковый белок S человеческого коронавируса HKU1: роль в жизненном цикле вируса и применение в обнаружении антител. Exp. Биол. Med. 233 , 1527–1536 (2008).
CAS Google ученый
Le Coupanec, A. et al. Расщепление нейроинвазивного гликопротеина респираторного вируса человека пропротеинконвертазами модулирует нейровирулентность и распространение вируса в центральной нервной системе. PLoS Pathog. 11 , e1005261 (2015).
PubMed PubMed Central Google ученый
Милле, Дж. К., Уиттакер, Г. Р., Миллет, Дж. К. и Уиттакер, Г. Р. Проникновение в клетки-хозяева коронавируса ближневосточного респираторного синдрома после двухэтапной фурин-опосредованной активации спайкового белка. Proc. Natl Acad. Sci. США 111 , 15214–15219 (2014).
Google ученый
Zhou, H. et al. Новый коронавирус летучих мышей, тесно связанный с SARS-CoV-2, содержит естественные вставки в сайте расщепления S1 / S2 белка-шипа. Curr. Биол . https://doi.org/10.1016/j.cub.2020.05.023 (2020).
Pfaender, S. et al. LY6E нарушает слияние коронавируса и обеспечивает иммунный контроль над вирусным заболеванием. Нац. Microbiol. https://doi.org/10.1038/s41564-020-0769-y (2020).
Артикул PubMed Google ученый
Buchholz, U.J. et al. Вклад структурных белков коронавируса тяжелого респираторного синдрома в защитный иммунитет. Proc. Natl Acad. Sci. США 101 , 9804–9809 (2004).
CAS PubMed Google ученый
Walls, A.C. et al. Гликановая защита и маскировка эпитопа шипованного белка коронавируса, наблюдаемая с помощью криоэлектронной микроскопии. Нац. Struct. Мол. Биол. 23 , 899–905 (2016).
CAS PubMed PubMed Central Google ученый
Ватанабе, Ю., Аллен, Дж. Д., Рэпп, Д., Маклеллан, Дж. С. и Криспин, М. Сайт-специфический гликановый анализ шипа SARS-CoV-2. Наука https://doi.org/10.1126/science.abb9983 (2020).
Артикул PubMed PubMed Central Google ученый
Pinto, D. et al. Перекрестная нейтрализация SARS-CoV-2 человеческим моноклональным антителом против SARS-CoV. Природа 583 , 290–295 (2020).
CAS PubMed Google ученый
Wang, C. et al. Человеческое моноклональное антитело, блокирующее инфекцию SARS-CoV-2. Нац. Commun. 11 , 2251 (2020).
CAS PubMed PubMed Central Google ученый
Cao, Y. et al. Мощные нейтрализующие антитела против SARS-CoV-2, идентифицированные высокопроизводительным одноклеточным секвенированием В-клеток выздоравливающих пациентов. Ячейка 182 , 73–84 (2020).
CAS PubMed PubMed Central Google ученый
Wrapp, D. et al. Структурная основа мощной нейтрализации бета-коронавирусов однодоменными антителами верблюдовых. Ячейка 181 , 1436–1441 (2020).
CAS PubMed PubMed Central Google ученый
Wu, Y. et al. Неконкурентная пара нейтрализующих антител человека блокирует связывание вируса COVID-19 с его рецептором ACE2. Наука 368 , 1274–1278 (2020).
CAS PubMed PubMed Central Google ученый
Finkel, Y. et al. Кодирующая способность SARS-CoV-2. Препринт на bioRxiv https://doi.org/10.1101/2020.05.07.082909 (2020).
Артикул PubMed PubMed Central Google ученый
Irigoyen, N. et al. Анализ экспрессии генов коронавируса с высоким разрешением с помощью секвенирования РНК и профилирования рибосом. PLoS Pathog. 12 , e1005473 (2016). Первый анализ рибосомного профилирования клеток, инфицированных коронавирусом, обеспечивающий всесторонний обзор экспрессии гена коронавируса .
PubMed PubMed Central Google ученый
Денисон, М. Р. и Перлман, С. Трансляция и обработка РНК вириона вируса гепатита мыши в бесклеточной системе. J. Virol. 60 , 12–18 (1986).
CAS PubMed PubMed Central Google ученый
Kamitani, W. et al. Белок nsp1 коронавируса тяжелого острого респираторного синдрома подавляет экспрессию генов хозяина, способствуя деградации мРНК хозяина. Proc. Natl Acad. Sci. США 103 , 12885–12890 (2006).
CAS PubMed Google ученый
Thoms, M. et al. Структурная основа остановки трансляции и уклонения от иммунитета белком Nsp1 SARS-CoV-2. Наука https://doi.org/10.1126/science.abc8665 (2020).
Артикул PubMed PubMed Central Google ученый
Schubert, K. et al. SARS-CoV-2 Nsp1 связывает рибосомный канал мРНК, подавляя трансляцию. Нац. Struct. Мол. Биол. https://doi.org/10.1038/s41594-020-0511-8 (2020). Вместе с Thoms, M. et al., Эта статья демонстрирует связывание SARS-CoV-2 nsp1 с каналом входа мРНК 40S субъединицы рибосомы, что приводит к ингибированию трансляции.
Артикул PubMed PubMed Central Google ученый
Sims, A.C., Ostermann, J. & Denison, M.R. Белки репликазы вируса гепатита мышей связаны с двумя различными популяциями внутриклеточных мембран. J. Virol. 74 , 5647–5654 (2000).
CAS PubMed PubMed Central Google ученый
Снайдер Э. Дж., Декрол Э. и Зибур Дж. Неструктурные белки, управляющие синтезом и процессингом РНК коронавируса. Adv. Virus Res. 96 , 59–126 (2016).
CAS PubMed PubMed Central Google ученый
Вьковски П. и др. Определение белков-хозяев, составляющих микросреду комплексов репликазы коронавируса, с помощью метки близости. eLife 8 , e42037 (2019).
PubMed PubMed Central Google ученый
Gao, Y.и другие. Структура РНК-зависимой РНК-полимеразы вируса COVID-19. Наука 368 , 779–782 (2020). Выясняет молекулярную структуру РНК-зависимой РНК-полимеразы SARS-CoV-2 .
CAS PubMed PubMed Central Google ученый
Tvarogová, J. et al. Идентификация и характеристика человеческого коронавируса 229E. Активность 3′-концевой аденилилтрансферазы, ассоциированной с неструктурным белком 8, РНК. Дж. Вирол . https://doi.org/10.1128/JVI.00291-19 (2019).
Eckerle, L. D., Lu, X., Sperry, S. M., Choi, L. & Denison, M. R. Высокая точность репликации вируса гепатита мышей снижена у мутантов по экзорибонуклеазе nsp14. J. Virol. 81 , 12135–12144 (2007). Экспериментальные доказательства участия активности экзонуклеазы nsp14 в целостности генома коронавируса, что привело в последующих исследованиях к концепции функции проверки РНК во время синтеза РНК коронавируса .
CAS PubMed PubMed Central Google ученый
Иванов, К. А., Зибур, Дж. Неструктурный белок 13 коронавируса человека 229Е: характеристика активности дуплекса-раскручивания, нуклеозидтрифосфатазы и 5′-трифосфатазы РНК. J. Virol. 78 , 7833–7838 (2004).
CAS PubMed PubMed Central Google ученый
Chen, Y. et al. Биохимические и структурные сведения о механизмах 2′-O-метилирования рибозы РНК коронавируса SARS белковым комплексом nsp16 / nsp10. PLoS Pathog. 7 , e1002294 (2011).
CAS PubMed PubMed Central Google ученый
Chen, Y. et al. Функциональный скрининг выявляет неструктурный белок коронавируса SARS nsp14 как новую кэп-метилтрансферазу N7. Proc. Natl Acad.Sci. США 106 , 3484–3489 (2009). Открытие метилтрансферазы N7 в nsp14 SARS-CoV как части его механизма кэпирования РНК .
CAS PubMed Google ученый
Zhang, L. et al. Кристаллическая структура основной протеазы SARS-CoV-2 является основой для создания улучшенных ингибиторов α-кетоамида. Наука 368 , 409–412 (2020).
CAS PubMed PubMed Central Google ученый
Ананд, К., Зибур, Дж., Вадхвани, П., Местерс, Дж. Р., Хильгенфельд, Р. Структура основной протеиназы коронавируса (3CLpro): основа для разработки препаратов против SARS. Наука 300 , 1763–1767 (2003).
CAS PubMed Google ученый
Jin, Z. et al. Структура M pro вируса COVID-19 и открытие его ингибиторов. Природа 582 , 289–293 (2020).
CAS PubMed PubMed Central Google ученый
Sawicki, S. G. & Sawicki, D. L. Коронавирусы используют прерывистое удлинение для синтеза отрицательных цепей субгеномной длины. Adv. Exp. Med. Биол. 380 , 499–506 (1995). Описание механизма прерывистого синтеза РНК, используемого для получения коронавирусных субгеномных РНК. Установлено существование и функциональное значение вирусных субгеномных отрицательно-смысловых РНК .
CAS PubMed Google ученый
Sola, I., Almazán, F., Zúñiga, S. & Enjuanes, L. Непрерывный и прерывистый синтез РНК в коронавирусах. Annu. Rev. Virol. 2 , 265–288 (2015).
CAS PubMed PubMed Central Google ученый
Kim, D. et al. Архитектура транскриптома SARS-CoV-2. Ячейка 181 , 914–921 (2020).
CAS PubMed PubMed Central Google ученый
Viehweger, A. et al. Прямое секвенирование нанопор РНК полноразмерных геномов коронавируса позволяет по-новому взглянуть на структурные варианты и провести анализ модификаций. Genome Res. 29 , 1545–1554 (2019).
CAS PubMed PubMed Central Google ученый
Ди, Х., Макинтайр, А. и Бринтон, М. А. Новое понимание регуляции субгеномного синтеза мРНК нидовирусов. Вирусология 517 , 38–43 (2018).
CAS PubMed PubMed Central Google ученый
Thao, T. T. N. et al. Быстрая реконструкция SARS-CoV-2 с использованием платформы синтетической геномики. Природа https://doi.org/10.1038/s41586-020-2294-9 (2020).
Артикул Google ученый
Yin, W. et al. Структурная основа ингибирования РНК-зависимой РНК-полимеразы SARS-CoV-2 ремдесивиром. Наука 368 , 1499–1504 (2020).
CAS PubMed PubMed Central Google ученый
Hillen, H. S. et al. Структура реплицирующейся полимеразы SARS-CoV-2. Природа 584 , 154–156 (2020).
CAS PubMed Google ученый
Gordon, C.J. et al. Ремдесивир – это противовирусный препарат прямого действия, который с высокой эффективностью ингибирует РНК-зависимую РНК-полимеразу от коронавируса 2 тяжелого острого респираторного синдрома. J. Biol. Chem. 295 , 6785–6797 (2020). Описывает понимание механизма действия ремдесивира, такого как задержка обрыва цепи, которая возникает в результате включения ремдесивира в формирующуюся РНК SARS-CoV-2 с помощью РНК-зависимой РНК-полимеразы .
CAS PubMed PubMed Central Google ученый
Sheahan, T. P. et al. Противовирусный препарат широкого спектра действия GS-5734 подавляет как эпидемические, так и зоонозные коронавирусы. Sci. Transl Med. 9 , eaal3653 (2017).
PubMed PubMed Central Google ученый
Wang, Q. et al. Структурная основа репликации РНК полимеразой SARS-CoV-2. Ячейка 182 , 417–428 (2020).
CAS PubMed PubMed Central Google ученый
Ferron, F. et al. Структурно-молекулярные основы коррекции несоответствия и удаления рибавирина из РНК коронавируса. Proc. Natl Acad. Sci. США 115 , E162 – E171 (2017).
PubMed Google ученый
Wang, M. et al. Ремдесивир и хлорохин эффективно подавляют недавно появившийся новый коронавирус (2019-nCoV) in vitro. Cell Res. 30, , 269–271 (2020).
Google ученый
Williamson, B.N. et al. Клиническая польза ремдесивира у макак-резусов, инфицированных SARS-CoV-2.Препринт на bioRxiv https://doi.org/10.1101/2020.04.15.043166 (2020).
Артикул PubMed Google ученый
Wang, Y. et al. Ремдесивир у взрослых с тяжелой формой COVID-19: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет 395 , 1569–1578 (2020).
CAS PubMed PubMed Central Google ученый
Shannon, A. et al. Фавипиравир поражает SARS-CoV-2 своей ахиллесовой пятой, РНК-полимеразой. Препринт на bioRxiv https://doi.org/10.1101/2020.05.15.098731 (2020).
Артикул PubMed Google ученый
Cai, Q. et al. Экспериментальное лечение COVID-19 фавипиравиром: открытое контрольное исследование. Engineering https://doi.org/10.1016/j.eng.2020.03.007 (2020).
Артикул Google ученый
Stertz, S. et al. Внутриклеточные сайты ранней репликации и почкования SARS-коронавируса. Вирусология 361 , 304–315 (2007).
CAS PubMed PubMed Central Google ученый
де Хаан, К. А. и Роттье, П. Дж. Молекулярные взаимодействия в сборке коронавирусов. Adv. Virus Res. 64 , 165–230 (2005).
PubMed PubMed Central Google ученый
Klein, S. et al. Структура и репликация SARS-CoV-2, охарактеризованные криоэлектронной томографией in situ. Препринт на bioRxiv https://doi.org/10.1101/2020.06.23.167064 (2020). Подробное ультраструктурное исследование репликационных структур SARS-CoV-2 и процесса сборки, в частности обнаружение вирусной (предположительно двухцепочечной) РНК внутри DMV .
Артикул PubMed PubMed Central Google ученый
Ghosh, S. et al. β-Коронавирусы используют лизосомальные органеллы для выхода клеток. Препринт на bioRxiv https://doi.org/10.1101/2020.07.25.1 (2020).
Артикул PubMed PubMed Central Google ученый
Konno, Y. et al. SARS-CoV-2 ORF3b является мощным антагонистом интерферона, активность которого дополнительно увеличивается за счет встречающегося в природе варианта удлинения. Препринт на bioRxiv https: // doi.org / 10.1101 / 2020.05.11.088179 (2020).
Артикул Google ученый
Bojkova, D. et al. Протеомика клеток-хозяев, инфицированных SARS-CoV-2, выявляет цели терапии. Природа 583 , 469–230 (2020).
CAS PubMed Google ученый
Xu, K. et al. Вспомогательный белок коронавируса 9b при тяжелом остром респираторном синдроме является белком, ассоциированным с вирионом. Вирусология 388 , 279–285 (2009).
CAS PubMed PubMed Central Google ученый
Davidson, A. D. et al. Характеристика транскриптома и протеома SARS-CoV-2 показывает, что пассаж клеток вызывает делецию в рамке считывания фуриноподобного сайта расщепления от гликопротеина шипа. Genome Med. 12 , 68 (2020).
CAS PubMed PubMed Central Google ученый
Копецки-Бромберг, С.А., Мартинес-Собридо, Л., Фриман, М., Барик, Р.А. и Палезе, П. Открытая рамка считывания (ОРС) коронавируса тяжелого острого респираторного синдрома (ОРС) 3b, ОРС 6 и белки нуклеокапсида действуют как антагонисты интерферона . J. Virol. 81 , 548–557 (2007).
CAS PubMed Google ученый
Shi, C.-S. и другие. Открытая рамка считывания-9b коронавируса SARS подавляет врожденный иммунитет, нацеливаясь на митохондрии и сигналосому MAVS / TRAF3 / TRAF6. J. Immunol. 193 , 3080–3089 (2014).
CAS PubMed PubMed Central Google ученый
Китайский консорциум молекулярной эпидемиологии SARS. Молекулярная эволюция коронавируса SARS в ходе эпидемии SARS в Китае. Наука 303 , 1666–1669 (2004).
Google ученый
Мут, Д.и другие. Ослабление репликации из-за делеции 29 нуклеотидов в коронавирусе SARS, приобретенном на ранних стадиях передачи от человека к человеку. Sci. Отчет 8 , 15177 (2018).
PubMed PubMed Central Google ученый
Zhang, Y. et al. Белок ORF8 SARS-CoV-2 опосредует уклонение от иммунитета за счет мощного подавления активности MHC-I. Препринт на bioRxiv https://doi.org/10.1101/2020.24.05.111823 (2020).
Артикул PubMed PubMed Central Google ученый
Su, Y. C. F. et al. Открытие и геномная характеристика 382-нуклеотидной делеции в ORF7B и orf8 во время ранней эволюции SARS-CoV-2. MBio 11 , e01610–20 (2020).
CAS PubMed PubMed Central Google ученый
Brockway, S.М., Лу, X. Т., Петерс, Т. Р., Дермоди, Т. С. и Денисон, М. Р. Внутриклеточная локализация и белковые взаимодействия белка p28 гена 1 во время репликации вируса гепатита у мышей. J. Virol. 78 , 11551–11562 (2004).
CAS PubMed PubMed Central Google ученый
Gosert, R., Kanjanahaluethai, A., Egger, D., Bienz, K. & Baker, S. C. Репликация РНК вируса гепатита мышей происходит в везикулах с двойной мембраной. J. Virol. 76 , 3697–3708 (2002). Первое свидетельство того, что коронавирусы индуцируют двойные мембранные структуры в цитоплазме инфицированных клеток .
CAS PubMed PubMed Central Google ученый
Angelini, M. M., Akhlaghpour, M., Neuman, B. W. & Buchmeier, M. J. Неструктурные белки 3, 4 и 6 коронавируса тяжелого острого респираторного синдрома индуцируют двойные мембранные везикулы. MBio 4 , e00524–13 (2013).
PubMed PubMed Central Google ученый
Oudshoorn, D. et al. Экспрессия и расщепление полипротеина nsp3-4 коронавируса ближневосточного респираторного синдрома вызывает образование двухмембранных везикул, которые имитируют везикулы, связанные с репликацией коронавирусной РНК. MBio https://doi.org/10.1128/mBio.01658-17 (2017).
Лундин, А.и другие. Нацеливание на синтез мембраносвязанной вирусной РНК обнаруживает мощное ингибирование различных коронавирусов, включая вирус ближневосточного респираторного синдрома. PLoS Pathog. 10 , e1004166 (2014).
PubMed PubMed Central Google ученый
Knoops, K. et al. Репликация SARS-коронавируса поддерживается ретикуловезикулярной сетью модифицированного эндоплазматического ретикулума. PLoS Biol. 6 , e226 (2008). Знаковое исследование, показывающее степень компартментов мембранной репликации SARS-CoV с помощью электронной томографии и локализацию вирусных nsps и dsRNA в инфицированных клетках .
PubMed PubMed Central Google ученый
Maier, H.J. et al. Вирус инфекционного бронхита образует шарики из покрытых застежками молний мембран эндоплазматической сети. МБио 4 , e00801-13 (2013).
PubMed PubMed Central Google ученый
Снайдер, Э. Дж. И др. Объединяющая структурная и функциональная модель органеллы репликации коронавируса: отслеживание синтеза РНК. PLoS Biol. 18 , e3000715 (2020).
CAS PubMed PubMed Central Google ученый
Ulasli, M., Verheije, M. H., de Haan, C. A. & Reggiori, F. Качественный и количественный ультраструктурный анализ перестроек мембран, вызванных коронавирусом. Cell Microbiol. 12 , 844–861 (2010).
CAS PubMed PubMed Central Google ученый
Wolff, G. et al. Молекулярная пора охватывает двойную мембрану органеллы репликации коронавируса. Наука 369 , 1395–1398 (2020). Идентификация поры, соединяющей внутреннюю часть DMV коронавируса с цитозолем, тем самым обеспечивая правдоподобную концепцию того, как вирусные РНК могут выходить из DMV .
CAS PubMed PubMed Central Google ученый
Оверби, А. К., Попов, В. Л., Нидриг, М. и Вебер, Ф. Вирус клещевого энцефалита задерживает индукцию интерферона и скрывает свою двухцепочечную РНК во внутриклеточных мембранных везикулах. J. Virol. 84 , 8470–8483 (2010).
PubMed PubMed Central Google ученый
Аль-Мулла, Х. М. и др. Конкурентная пригодность коронавирусов не коррелирует с размером или количеством везикул с двойной мембраной в условиях роста при пониженной температуре. МБио 5 , e01107-13 (2014).
PubMed PubMed Central Google ученый
Maier, H.J. et al. Обширные перестройки мембран, вызванные коронавирусом, не являются определяющим фактором патогенности. Sci. Отчет 6 , 27126 (2016).
CAS PubMed PubMed Central Google ученый
Oudshoorn, D. et al. Противовирусный врожденный иммунный ответ препятствует образованию ассоциированных с репликацией мембранных структур, индуцированных вирусом с положительной цепью РНК. МБио https://doi.org/10.1128/mBio.01991-16 (2016).
Athmer, J. et al. Помеченный in situ nsp15 обнаруживает взаимодействия с белками, связанными с комплексом репликации / транскрипции коронавируса. MBio https://doi.org/10.1128/MBIO.02320-16 (2017).
Knoops, K. et al. Целостность раннего секреторного пути способствует синтезу РНК коронавируса тяжелого острого респираторного синдрома и индуцированному вирусом ремоделированию мембран эндоплазматического ретикулума, но не требуется для этого. J. Virol. 84 , 833–846 (2010).
CAS PubMed Google ученый
Чжан Л., Zhang, Z. P., Zhang, X. E., Lin, F. S. & Ge, F. Количественный протеомный анализ показывает, что BAG3 является потенциальной мишенью для подавления репликации коронавируса тяжелого острого респираторного синдрома. J. Virol. 84 , 6050–6059 (2010).
CAS PubMed PubMed Central Google ученый
de Wilde, A.H. et al. Скрининг малой интерферирующей РНК шириной кинома выявляет провирусные и противовирусные факторы хозяина при репликации коронавируса тяжелого острого респираторного синдрома, включая двухцепочечную РНК-активированную протеинкиназу и белки раннего секреторного пути. J. Virol. 89 , 8318–8333 (2015).
PubMed PubMed Central Google ученый
Reggiori, F. et al. Коронавирусы захватывают LC3-I-позитивные EDEMосомы, производные от ER везикулы, экспортирующие короткоживущие регуляторы ERAD, для репликации. Клеточный микроб-хозяин 7 , 500–508 (2010).
CAS PubMed PubMed Central Google ученый
Wong, H.H. et al. Полногеномный скрининг выявляет потребность в белках, содержащих валозин, для выхода коронавируса из эндосом. J. Virol. 89 , 11116–11128 (2015).
CAS PubMed PubMed Central Google ученый
Schneider, M. et al. Репликация коронавируса тяжелого острого респираторного синдрома серьезно нарушается MG132 из-за протеасомно-независимого ингибирования М-кальпаина. Дж.Virol. 86 , 10112–10122 (2012).
CAS PubMed PubMed Central Google ученый
Gordon, D. E. et al. Карта взаимодействия белков SARS-CoV-2 выявляет цели для перепрофилирования лекарств. Природа 583 , 459–468 (2020).
CAS PubMed PubMed Central Google ученый
Riva, L. et al. Крупномасштабное исследование по репозиционированию противовирусных препаратов SARS-CoV-2.Препринт на bioRxiv https://doi.org/10.1101/2020.04.16.044016 (2020).
Артикул PubMed PubMed Central Google ученый
Li, J., Liu, Y. & Zhang, X. Коронавирус мыши индуцирует интерферон типа I в олигодендроцитах посредством распознавания RIG-I и MDA5. J. Virol. 84 , 6472–6482 (2010).
CAS PubMed PubMed Central Google ученый
Cervantes-Barragan, L. et al. Контроль за коронавирусной инфекцией с помощью интерферона I типа, полученного из плазматических дендритных клеток. Кровь 109 , 1131–1137 (2007).
CAS PubMed Google ученый
Zhang, W. et al. Мощное и избирательное ингибирование патогенных вирусов с помощью модифицированных вариантов убиквитина. PLoS Pathog. 13 , e1006372 (2017).
PubMed PubMed Central Google ученый
Clementz, M.A. et al. Деубиквитинирующая и интерфероновая антагонистическая активность папаин-подобных протеаз коронавируса. J. Virol. 84 , 4619–4629 (2010).
CAS PubMed PubMed Central Google ученый
Grunewald, M. E. et al. Макродомен коронавируса необходим для предотвращения PARP-опосредованного ингибирования репликации вируса и повышения экспрессии IFN. PLoS Pathog. 15 , e1007756 (2019).
CAS PubMed PubMed Central Google ученый
Zust, R. et al. 2′-O-метилирование рибозы обеспечивает молекулярную сигнатуру для различения собственной и чужой мРНК, зависящей от сенсора РНК Mda5. Нац. Иммунол. 12 , 137–143 (2011).
PubMed PubMed Central Google ученый
Daffis, S. et al. 2′-O метилирование кэпа вирусной мРНК позволяет избежать ограничения хозяина членами семейства IFIT. Природа 468 , 452–456 (2010). Вместе с Zust, R. et al., Эта статья определяет роль вирусного cap-1 2′-O-метилирования в уклонении от врожденных иммунных ответов хозяина.
CAS PubMed PubMed Central Google ученый
Минская Е. и др. Открытие 3 ‘-> 5’ экзорибонуклеазы РНК-вируса, которая критически участвует в синтезе РНК коронавируса. Proc. Natl Acad. Sci.США 103 , 5108–5113 (2006).
CAS PubMed Google ученый
Kindler, E. et al. Раннее опосредованное эндонуклеазой уклонение от восприятия РНК обеспечивает эффективную репликацию коронавируса. PLoS Pathog. 13 , e1006195 (2017).
PubMed PubMed Central Google ученый
Deng, X. et al. Неструктурный белок коронавируса 15 опосредует уклонение от сенсоров дцРНК и ограничивает апоптоз в макрофагах. Proc. Natl Acad. Sci. США 114 , E4251 – E4260 (2017).
CAS PubMed Google ученый
Canton, J. et al. Белок MERS-CoV 4b препятствует NF-kappaB-зависимому врожденному иммунному ответу во время инфекции. PLoS Pathog. 14 , e1006838 (2018).
PubMed PubMed Central Google ученый
Тай, М. З., По, К. М., Рения, Л., Макари, П. А. и Нг, Л. Ф. П. Троица COVID-19: иммунитет, воспаление и вмешательство. Нац. Rev. Immunol. 20 , 363–337 (2020).
CAS PubMed Google ученый
Vabret, N. et al. Иммунология COVID-19: современное состояние науки. Иммунитет 52 , 910–941 (2020).
CAS PubMed PubMed Central Google ученый
Channappanavar, R. et al. Нарушение регуляции интерферона I типа и воспалительные реакции моноцитов-макрофагов вызывают летальную пневмонию у мышей, инфицированных SARS-CoV. Клеточный микроб-хозяин 19 , 181–193 (2016). Исследование, показывающее важность быстрого и сильного ответа интерферона типа I для предотвращения летальной инфекции SARS-CoV на мышиной модели .
CAS PubMed PubMed Central Google ученый
Chua, R. L. et al. Перекрестная связь между эпителием дыхательных путей и активированными иммунными клетками определяет тяжесть COVID-19. Препринт medRxiv https://doi.org/10.1101/2020.04.29.20084327 (2020).
Артикул Google ученый
Вьковски П. и др. Несопоставимая динамика зависимого от температуры вируса – хозяина для SARS-CoV-2 и SARS-CoV в респираторном эпителии человека. Препринт на bioRxiv https: // doi.org / 10.1101 / 2020.04.27.062315 (2020).
Артикул PubMed PubMed Central Google ученый
Giamarellos-Bourboulis, E.J. et al. Комплексная иммунная дисрегуляция у пациентов с COVID-19 с тяжелой дыхательной недостаточностью. Cell Host Microbe 27 , 992–1000 (2020).
CAS PubMed PubMed Central Google ученый
Ляо, М.и другие. Одноклеточный ландшафт бронхоальвеолярных иммунных клеток у пациентов с COVID-19. Нац. Med. 26 , 842–844 (2020).
CAS PubMed Google ученый
Чжун, Дж., Тан, Дж., Йе, К. и Донг, Л. Иммунология COVID-19: является ли иммуномодуляция вариантом лечения? Lancet Rheumatol. 2 , e428 – e436 (2020).
PubMed PubMed Central Google ученый
Li, H. et al. Влияние кортикостероидной терапии на исходы у людей с инфекцией SARS-CoV-2, SARS-CoV или MERS-CoV: систематический обзор и метаанализ. Лейкоз 34 , 1503–1511 (2020).
CAS PubMed Google ученый
Zhang, X. et al. Факторы вируса и хозяина, связанные с клиническим исходом COVID-19. Природа https://doi.org/10.1038/s41586-020-2355-0 (2020).
Артикул PubMed PubMed Central Google ученый
Bost, P. et al. Карты вирусной инфекции хозяина показывают признаки тяжелых пациентов с COVID-19. Ячейка https://doi.org/10.1016/j.cell.2020.05.006 (2020).
Артикул PubMed PubMed Central Google ученый
Wen W. et al. Профилирование иммунных клеток пациентов с COVID-19 на стадии выздоровления с помощью одноклеточного секвенирования. Cell Discov. 6 , 31 (2020).
CAS PubMed PubMed Central Google ученый
Shan, C. et al. Инфекция новым коронавирусом (SARS-CoV-2) вызывает пневмонию у макак-резусов. Cell Res. 30 , 670–677 (2020).
CAS PubMed PubMed Central Google ученый
Munster, V.J. et al. Респираторное заболевание у макак-резусов, зараженных SARS-CoV-2. Природа https://doi.org/10.1038/s41586-020-2324-7 (2020).
Артикул PubMed PubMed Central Google ученый
McAuliffe, J. et al. Репликация коронавируса SARS, введенного в дыхательные пути африканских зеленых, резусов и яванских макак. Вирусология https://doi.org/10.1016/j.virol.2004.09.030 (2004).
Артикул PubMed PubMed Central Google ученый
Woolsey, C. B. et al. Создание модели африканской зеленой обезьяны на COVID-19. Препринт на bioRxiv https://doi.org/10.1101 / 2020.05.17.100289 (2020).
Артикул PubMed PubMed Central Google ученый
Dinnon, K.H. et al. Адаптированная к мышам модель SARS-CoV-2 для оценки медицинских мер противодействия COVID-19. Препринт на bioRxiv https://doi.org/10.1101/2020.05.06.081497 (2020).
Артикул PubMed PubMed Central Google ученый
Bao, L. et al. Патогенность SARS-CoV-2 у трансгенных мышей hACE2. Природа 583 , 830–833 (2020).
CAS Google ученый
Netland, J., Meyerholz, D. K., Moore, S., Cassell, M. & Perlman, S. Тяжелая инфекция, вызванная коронавирусом острого респираторного синдрома, вызывает гибель нейронов в отсутствие энцефалита у мышей, трансгенных по человеческому ACE2. J. Virol. https://doi.org/10.1128 / jvi.00737-08 (2008).
Артикул PubMed PubMed Central Google ученый
Shi, J. et al. Восприимчивость хорьков, кошек, собак и других домашних животных к SARS – коронавирусу 2. Science 368 , 1016–1020 (2020).
CAS PubMed PubMed Central Google ученый
Kim, Y. Y. Il et al. Инфекция и быстрое распространение SARS-CoV-2 у хорьков. Cell Host Microbe https://doi.org/10.1016/j.chom.2020.03.023 (2020).
Артикул PubMed PubMed Central Google ученый
Park, S.J. et al. Противовирусная эффективность одобренных FDA препаратов против инфекции SARS-COV-2 у хорьков. МБио https://doi.org/10.1128/mBio.01114-20 (2020).
Martina, B.E.E. et al. . Заражение вирусом ОРВИ кошек и хорьков. Nature https://doi.org/10.1038/425915a (2003).
Sia, S. F. et al. Патогенез и передача SARS-CoV-2 у золотистых хомяков. Природа https://doi.org/10.1038/s41586-020-2342-5 (2020).
Chan, J. F. W. et al. Моделирование клинических и патологических проявлений коронавирусной болезни 2019 (COVID-19) в модели золотого сирийского хомяка: последствия для патогенеза и передачи заболевания. Clin.Заразить. Dis . https://doi.org/10.1093/cid/ciaa325 (2020).
Zhou, J. et al. Заражение органоидов кишечника летучих мышей и человека SARS-CoV-2. Нац. Med. https://doi.org/10.1038/s41591-020-0912-6 (2020).
Monteil, V. et al. Ингибирование инфекций SARS-CoV-2 в тканях человека с использованием растворимого человеческого ACE2 клинического уровня. Ячейка https://doi.org/10.1016/j.cell.2020.04.004 (2020).
Эллисон, С.J. Инфекция почечных органоидов SARS-CoV-2, предотвращаемая растворимым человеческим ACE2. Нац. Преподобный Нефрол . https://doi.org/10.1038/s41581-020-0291-8 (2020).
Hui, K. P. Y. et al. Тропизм, репликационная способность и врожденные иммунные ответы коронавируса SARS-CoV-2 в дыхательных путях и конъюнктиве человека: анализ на культурах ex vivo и in vitro. Ланцет Респир. Med. https://doi.org/10.1016/S2213-2600(20)30193-4 (2020).
Артикул PubMed PubMed Central Google ученый
Hou, Y. J. et al. Обратная генетика SARS-CoV-2 выявляет переменный градиент инфекции в дыхательных путях. Ячейка https://doi.org/10.1016/j.cell.2020.05.042 (2020).
Артикул PubMed PubMed Central Google ученый
Xie, X. et al. Инфекционный клон кДНК SARS-CoV-2. Клеточный микроб-хозяин 27 , 841–848 (2020).
CAS PubMed PubMed Central Google ученый
Day, C. W. et al. Новый адаптированный к мышам штамм SARS-CoV в качестве летальной модели для оценки противовирусных агентов in vitro и in vivo. Вирусология https://doi.org/10.1016/j.virol.2009.09.023 (2009).
Артикул PubMed PubMed Central Google ученый
Roberts, A. et al. Адаптированный к мышам коронавирус SARS вызывает заболевание и смертность у мышей BALB / c. PLoS Pathog. https://doi.org/10.1371/journal.ppat.0030005 (2007).
Артикул PubMed PubMed Central Google ученый
Thiel, V. et al. Механизмы и ферменты, участвующие в экспрессии генома коронавируса SARS. J. Gen. Virol. 84 , 2305–2315 (2003).
CAS PubMed Google ученый
Лей, Дж., Кусов, Ю. и Хильгенфельд, Р. Nsp3 коронавирусов: структуры и функции большого многодоменного белка. Антивирь. Res. 149 , 58–74 (2018).
CAS PubMed Google ученый
Boursnell, M. E. G. et al. Завершение последовательности генома коронавируса вируса инфекционного бронхита птиц. J. Gen. Virol. 68 , 57–77 (1987).
CAS PubMed Google ученый
Кетцнер, К. А., Паркер, М.М., Рикар С. С., Стурман Л. С. и Мастерс П. С. Ремонт и мутагенез генома делеционного мутанта вируса вирусного гепатита коронавируса мыши путем направленной рекомбинации РНК. J. Virol. 66 , 1841–1848 (1992).
CAS PubMed PubMed Central Google ученый
Van Der Most, RG, Heijnen, L., Spaan, WJM & De Groot, RJ Гомологичная рекомбинация РНК позволяет эффективно вводить сайт-специфические мутации в геном коронавируса mhv-a59 через синтетические ко-реплицирующиеся РНК . Nucleic Acids Res. 20 , 3375–3381 (1992).
PubMed PubMed Central Google ученый
Thiel, V., Herold, J., Schelle, B. & Siddell, SG Инфекционная РНК, транскрибированная in vitro из кДНК-копии генома человеческого коронавируса, клонированной в вирусе коровьей оспы. в этой статье – AF304460. J. Gen. Virol. 82 , 1273–1281 (2001).
CAS PubMed Google ученый
Almazán, F. et al. Разработка генома крупнейшего РНК-вируса в качестве искусственной хромосомы инфекционных бактерий. Proc. Natl Acad. Sci. США 97 , 5516–5521 (2000).
PubMed Google ученый
Чжун, Н. С. и др. Эпидемиология и причина тяжелого острого респираторного синдрома (SARS) в Гуандуне, Китайская Народная Республика, в феврале 2003 г. Ланцет 362 , 1353–1358 (2003).
CAS PubMed PubMed Central Google ученый
Ksiazek, T. G. et al. Новый коронавирус, связанный с тяжелым острым респираторным синдромом. N. Engl. J. Med. 348 , 1953–1966 (2003).
CAS Google ученый
van der Hoek, L. et al. Выявление нового коронавируса человека. Нац. Med. 10 , 368–373 (2004).
PubMed PubMed Central Google ученый
Woo, P. C. et al. Характеристика и полная последовательность генома нового коронавируса, коронавируса HKU1, от пациентов с пневмонией. J. Virol. 79 , 884–895 (2005).
CAS PubMed PubMed Central Google ученый
Garbino, J. et al. Проспективное больничное исследование клинического воздействия коронавирусной инфекции человека, связанной с нетяжелым острым респираторным синдромом (не SARS). Clin. Заразить. Дис. 43 , 1009–1015 (2006).
PubMed PubMed Central Google ученый
Заки, А.М., ван Бохимен, С., Бестеброер, Т.М., Остерхаус, А.Д. и Фушье, Р.А. Изоляция нового коронавируса от человека с пневмонией в Саудовской Аравии. N. Engl. J. Med. 367 , 1814–1820 (2012).
CAS Google ученый
Memish, Z. A. et al. Коронавирус ближневосточного респираторного синдрома у летучих мышей, Саудовская Аравия. Emerg. Заразить. Дис. 19 , 1819–1823 (2013).
CAS PubMed PubMed Central Google ученый
Haagmans, B. L. et al. Коронавирус ближневосточного респираторного синдрома у верблюдов-верблюдов: расследование вспышки. Ланцетная инфекция. Дис. 14 , 140–145 (2014).
CAS PubMed Google ученый
Zhu, N. et al. Новый коронавирус от пациентов с пневмонией в Китае, 2019. N. Engl. J. Med. 382 , 727–733 (2020).
CAS PubMed PubMed Central Google ученый
Huang, C. et al. Клинические особенности пациентов, инфицированных новым коронавирусом 2019 г., в Ухане, Китай. Ланцет 395 , 497–506 (2020).
CAS PubMed PubMed Central Google ученый
Böhmer, M. M. et al. Расследование вспышки COVID-19 в Германии, возникшей в результате одного первичного случая, связанного с поездкой: серия случаев. Ланцетная инфекция. Дис. 20 , 920–928 (2020).
PubMed PubMed Central Google ученый
Xu, Z. et al. Патологические данные COVID-19, связанные с острым респираторным дистресс-синдромом. Ланцет Респир. Med. 8 , 420–422 (2020).
CAS PubMed PubMed Central Google ученый
Guan, W. et al. Клиническая характеристика коронавирусной болезни 2019 в Китае. N. Engl. J. Med. 382 , 1708–1720 (2020).
CAS Google ученый
Zhang, Y.Z. & Holmes, E.C. Геномный взгляд на происхождение и возникновение SARS-CoV-2. Ячейка https://doi.org/10.1016/j.cell.2020.03.035 (2020).
Артикул PubMed PubMed Central Google ученый
Guan, Y. et al. Выделение и характеристика вирусов, связанных с коронавирусом SARS, от животных в Южном Китае. Наука 302 , 276–278 (2003).
CAS PubMed PubMed Central Google ученый
Lam, T. T. Y. et al. Выявление коронавирусов, связанных с SARS-CoV-2, у малайских панголинов. Природа https://doi.org/10.1038/s41586-020-2169-0 (2020).
Артикул PubMed PubMed Central Google ученый
Ge, X. Y. et al. Выделение и характеристика коронавируса, напоминающего атипичную пневмонию летучих мышей, который использует рецептор ACE2. Nature https://doi.org/10.1038/nature12711 (2013).
Артикул PubMed PubMed Central Google ученый
Цуй, Дж., Ли, Ф. и Ши, З.-Л. Происхождение и эволюция патогенных коронавирусов. Нац. Rev. Microbiol. 17 , 181–192 (2019).
CAS Google ученый
Активность кишечной дельта-6-десатуразы определяет диапазон хозяев для полового размножения токсоплазмы
Abstract
Многие эукариотические микробы имеют сложные жизненные циклы, которые включают как половую, так и бесполую фазы со строгой видовой специфичностью.В то время как бесполый цикл протистанского паразита Toxoplasma gondii может происходить у любого теплокровного млекопитающего, половой цикл ограничен кишечником кошек. Молекулярные детерминанты, которые определяют кошек как окончательных хозяев для T . gondii неизвестны. Здесь мы определили механизм видовой специфичности для T . gondii полового развития и преодоления видового барьера, чтобы позволить половому циклу протекать у мышей. Мы определили, что T . gondii половое развитие происходит, когда культивируемые эпителиальные клетки кишечника кошек дополняются линолевой кислотой. Кошки – единственные млекопитающие, у которых отсутствует активность дельта-6-десатуразы в кишечнике, которая необходима для метаболизма линолевой кислоты, что приводит к системному избытку линолевой кислоты. Мы обнаружили, что ингибирование мышиной дельта-6-десатуразы и добавление к их рациону линолевой кислоты позволило получить T . gondii половое развитие мышей. Этот механизм видовой специфичности был впервые определен для полового цикла паразита.В этой работе показано, как диета и метаболизм хозяина влияют на коэволюцию микробов. Ключ к открытию видовых границ для других эукариотических микробов может также зависеть от липидного состава их среды, поскольку мы видим все больше доказательств важности липидного метаболизма хозяина во время паразитических жизненных циклов. Беременным женщинам не рекомендуется работать с наполнителем для кошачьего туалета, поскольку у матери имеется инфекция T . gondii может передаваться плоду с потенциально летальным исходом.Знание молекулярных компонентов, которые создают благоприятную среду для T . Половое размножение gondii позволит разработать терапевтические средства, предотвращающие выделение T . gondii паразиты. Наконец, учитывая текущую зависимость от животных-компаньонов для изучения T . gondii половое развитие, эту работу позволит T . gondii field для использования альтернативных моделей в будущих исследованиях.
Образец цитирования: Martorelli Di Genova B, Wilson SK, Dubey JP, Knoll LJ (2019) Активность кишечной дельта-6-десатуразы определяет диапазон хозяев для полового размножения Toxoplasma .ПЛоС Биол 17 (8): e3000364. https://doi.org/10.1371/journal.pbio.3000364
Академический редактор: Борис Стрипен, Университет Джорджии, США
Поступила: 19 июня 2019 г .; Принята к печати: 17 июля 2019 г .; Опубликовано: 20 августа 2019 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, строить или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Это исследование было поддержано Национальным институтом здравоохранения (NIH), Награда Национальной исследовательской службы T32 AI007414 (SKW), R01AI144016-01, 5R21AI1123289-02 и 5R03AI104697-02 (LJK) и Междисциплинарная стипендия Morgridge Metabolism. из Исследовательского института Моргриджа (BMDG).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Сокращения: АО2, аминоксидаза, медьсодержащий белок 2; BRP1, брадизоит роптрийный белок-1; DBA, Dolichos biflorus агглютинин; GRA11B, плотные гранулы белка 11В; МОИ, множественность заражения; КПЦР, количественная ПЦР; RNAseq, Секвенирование РНК; SAG1, поверхностный антиген 1; TUB1A, тубулин 1А; ЗО-1, зона окклюденс-1
Введение
Апикомплексный паразит Toxoplasma gondii вызывает хроническую инфекцию почти у одной трети населения и хорошо известен тем, что вызывает врожденные инфекции, приводящие к слепоте, умственной отсталости и гидроцефалии развивающегося плода. Т . gondii имеет сложный жизненный цикл, включающий как половую, так и бесполую фазы. Модель T . gondii бесполый цикл может возникнуть у любого теплокровного животного при употреблении зараженной пищи или воды, а T . gondii распространяется по всему хозяину, превращаясь в инцистированную форму в мышцах и тканях мозга. В отличие от T . gondii половой цикл ограничен эпителием кишечника кошек, кульминацией которого является выделение экологически устойчивых ооцист [1].Молекулярные основы этой видовой специфичности неизвестны.
При заражении кошек проглоченные брадизоиты выделяются пепсином и кислотой в желудке. Затем брадизоиты проникают в эпителий кишечника кошек и дифференцируются на пять морфологически различных типов шизонтов [2]. В течение 2 дней в кишечнике кошек паразиты проходят все пять стадий развития шизонтов, а затем превращаются в мерозоитов. Мерозоиты претерпевают ограниченную пролиферацию от двух до четырех удвоений, прежде чем они дифференцируются в макрогаметы и микрогаметы.Макро- и микрогаметы сливаются с образованием диплоидных ооцист, которые развивают толстые непроницаемые стенки и выделяются с фекалиями. Кошки обычно выделяют 2–20 миллионов ооцист в день с фекалиями и обычно выделяют ооцисты через 5–10 дней после заражения [3,4]. В условиях окружающего воздуха и температуры ооцисты подвергаются процессу спороношения, созревая и становясь заразными. И митоз, и мейоз происходят во время споруляции с образованием восьми гаплоидных спорозоитов, заключенных в стенку ооцисты. Т . gondii ооцисты стабильны в течение 18 месяцев в неблагоприятных условиях окружающей среды и устойчивы ко многим химическим дезинфицирующим средствам [5].
Результаты и обсуждение
Линолевая кислота имеет решающее значение для полового развития в культивируемых клетках кошек
Для определения молекулярных механизмов, определяющих видовую специфичность T . gondii , мы создали органоиды кишечника кошек (рис. 1а), а затем высеяли эти эпителиальные клетки на покровные стекла. Эти монослои проявляют свойства кишечного эпителия, включая поляризацию и образование плотных контактов (рис. 1b).Для имитации естественной инфекции T . gondii собирали из мозга мышей через 28-40 дней после первичного заражения, и паразиты были выпущены из цист мозга путем переваривания пепсином и кислотой. После нейтрализации карбонатом натрия паразитов высевали на монослои кишечника кошек, инкубировали в течение 5 дней и окрашивали на маркеры пресексуальной стадии паразита, называемые мерозоитом [6,7]. Хотя мы наблюдали случайное окрашивание плотных гранул белка 11B (GRA11B) и брадизоитного белка-1 (BRP1), подавляющее большинство культур было отрицательным для этих маркеров мерозоитов (рис. 1c), что позволяет предположить, что необходимое питательное вещество ограничивало в этих условиях культивирования. .Поскольку недавние исследования показали, что модель T . gondii бесполые стадии удаляют жирные кислоты, особенно олеиновую кислоту, от хозяина [8], и что половое развитие многих грибов зависит от линолевой кислоты [9], мы предположили, что добавление этих жирных кислот может облегчить T . gondii половое развитие. Мы добавили 200 мкМ олеиновой или линолевой кислоты в монослойную культуральную среду кишечника кошки за 24 часа до инфицирования T . gondii .После 5 дней заражения мы обнаружили, что добавление линолевой кислоты, но не олеиновой кислоты, вызывало примерно 35% T . gondii для экспрессии обоих маркеров мерозоитной стадии (рис. 1d – 1g и 2a, данные S1). Точно так же мРНК GRA11B была значительно больше в клетках кишечника кошек, дополненных линолевой кислотой, по сравнению с любым другим состоянием (рис. 2b, данные S2). Как видно из кишечника кошек in vivo, GRA11B изменяет локализацию из плотных гранулярных органелл паразита на ранних стадиях развития на паразитофорную вакуоль и мембрану паразитофорной вакуоли на более поздних стадиях развития [6].Мы видим сходную локализацию GRA11B в зависимости от размера вакуолей, вероятно, представляющих раннюю, среднюю и позднюю стадии (Рис. 1e – 1g). Сходным образом, BRP1 имеет локализацию, подобную той, что ранее наблюдалась в органеллах rhoptry на апикальном конце мерозоитов [7] (Fig 1e-1g).
Рис. 1. Линолевая кислота способствует развитию половой жизни.
(a) Органоиды кишечника кошек получали из срезов тонкого кишечника и выращивали в матриксе базальной мембраны. Пример растущего органоида, полоска размером 100 мкм.(b) Органоиды кишечника диссоциировали с использованием трипсина, и отдельные клетки высевали на покровные стекла для роста в виде монослоев. Клетки в монослое экспрессировали белок плотных контактов ZO-1 (зеленый), столбик размером 20 мкм. Монослои кишечника кошек инкубировали либо (c) без добавления жирных кислот, (d) 200 мкМ олеиновой кислоты, либо (e, f, g) 200 мкМ линолевой кислоты в течение 24 часов, а затем инфицировали брадизоитами ME49 в течение 5 дней. Паразиты, подвергающиеся пресексуальному развитию, обычно наблюдались только при добавлении линолевой кислоты, что было отмечено окрашиванием GRA11B (красный) или BRP1 (зеленый).Паразиты на (д) ранних, (е) средних или (ж) поздних стадиях полового развития были отмечены по дифференциальной локализации GRA11B. Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. BRP1, брадизоит роптрийный белок-1; ДИК – дифференциально-интерференционный контраст; GRA11B, плотные гранулы белка 11B; ZO-1, окклюдированная зона 1.
https://doi.org/10.1371/journal.pbio.3000364.g001
Рис. 2. Количественное определение мерозоитов в культуре тканей кошек.
(a) Органоиды кишечника кошек были диссоциированы трипсином и затем выращены в виде монослоев на предметных стеклах. Срезы были разделены на три разные группы: без добавления FA, с добавлением 200 мкМ OA или с добавлением 200 мкМ LA. Монослои были инфицированы T . gondii брадизоиты ME49, очищенные из мозга мышей с хронической инфекцией при MOI 1:10. Через пять дней после заражения окрашивание на GRA11B и BRP1 вместе с DAPI позволило определить процент вакуолей, положительных по GRA11B и BRP1, от общего числа вакуолей.Общее количество паразитофорных вакуолей подсчитывали с помощью положительного окрашивания DAPI и подтверждали морфологией с помощью DIC. Было подсчитано три биологических повтора, и в среднем 35% всех вакуолей были положительными как для GRA11B, так и для BRP1 в монослоях, дополненных LA. * p -значение = 0,0126 с N = 3 по двустороннему непарному тесту t . Для подсчета стадий мерозоитов использовали деформацию как для BRP1, так и для GRA11B. RNAseq и иммунофлуоресцентная визуализация кишечного эпителия кошек показывают, что GRA11B экспрессируется исключительно в мерозоитах [6].BRP1 представляет собой белок rhoptry, который первоначально был обнаружен в брадизоитах; однако он также выражен в мерозоитах [7]. (b) Монослои кишечника кошек выращивали, как описано в (а), за исключением того, что монослои гасили TRIzol через 5 дней после заражения, экстрагировали РНК и синтезировали кДНК с использованием праймера олиго (dT) для амплификации мРНК. Экспрессию SAG1 и GRA11B количественно оценивали с помощью qPCR и рассчитывали кратное изменение по сравнению с неинфицированными клетками. TUB1A использовали для нормализации экспрессии генов в образцах.Экспрессия GRA11B была значительно выше в монослоях, дополненных LA, с двумя биологическими повторами. * p -значение = 0,0155 с N = 2 по двустороннему непарному тесту t . BRP1, брадизоит роптрийный белок-1; ДИК – дифференциально-интерференционный контраст; ЖК, жирная кислота; GRA11B, плотные гранулы белка 11B; LA, линолевая кислота; MOI – множественность инфекции; ОА, олеиновая кислота; qPCR, количественная ПЦР; RNAseq – секвенирование РНК; ТУБ1А, тубулин 1А; SAG1, поверхностный антиген 1.
https://doi.org/10.1371/journal.pbio.3000364.g002
Известно, что в кишечнике кошек мерозоиты дифференцируются на микро- и макрогаметы, которые сливаются в диплоидные ооцисты. После 7 дней заражения мы наблюдали круглые структуры с реактивностью к макрогамете протеинаминоксидазы, медьсодержащему протеину 2 (АО2) [10] в монослоях кишечника кошек, культивируемых с 200 мкМ линолевой кислоты, но не в культурах без добавок или олеиновой кислоты. (Рис. 3a – 3c).ПЦР этих 7-дневных культур, дополненных линолевой кислотой, усилил сообщение для AO2, а также предсказанного моторного белка динеина жгутика микрогаметы TGME49_306338 с 44% идентичностью с гомологом из подвижной зеленой водоросли Chlamydomonas reinhardtii (рис. 3d). Параллельно мы оценили наличие внутриклеточного биогенеза стенки ооцисты в этих клетках кошек, дополненных линолевой кислотой, с помощью антитела 3G4 [11], которое распознает T . gondii стенка ооцисты.Было приблизительно девять стенок ооцист на см. 2 культивируемых кошачьих клеток с добавлением 200 мкМ линолевой кислоты, но ни одного в культурах без добавок или олеиновой кислоты (рис. 3e-3h, данные S3). Добавление 20 мкМ линолевой кислоты не увеличивало продукцию стенок ооцисты, указывая на то, что концентрация линолевой кислоты была критической для правильного развития.
Рис. 3. Идентификация гамет и внутриклеточных ооцист в культуре ткани кошки.
Органоиды кишечника кошек были диссоциированы трипсином и затем выращены в виде монослоев на предметных стеклах.Монослои выращивали до слияния, а затем инкубировали либо без добавления жирных кислот (a и e), 200 мкМ олеиновой кислоты (b и f), либо 200 мкМ линолевой кислоты (c и g) в течение 24 часов и инфицировали очищенными брадизоитами ME49. из мозга хронически инфицированных мышей. Через 7 дней монослои инкубировали с мышиным анти-AO2 (a – c) или мышиным моноклональным IgM 3G4 (e – g). Чувствительный к амилориду AO2 – это фермент, экспрессирующийся исключительно в макрогаметах и ранних ооцистах, и он, возможно, играет роль в биогенезе стенки ооцисты [10].Экспрессия АО2 была обнаружена только с помощью иммунофлуоресценции в монослоях с добавлением линолевой кислоты (c). 3G4 – мышиное моноклональное антитело, продуцируемое иммунизацией мышей очищенными стенками ооцист [11]; таким образом, это маркер биогенеза стенки ооцисты. Только монослои, дополненные линолевой кислотой (g), имели положительные вакуоли 3G4. Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. (d) Маркеры экспрессии макрогаметы и микрогаметы также оценивали с помощью ПЦР.Монослои кишечника кошек выращивали в 24-луночных планшетах до слияния, а затем инфицировали Т . gondii брадизоитов в двух экземплярах с использованием тех же условий, что и выше. Через семь дней после заражения РНК экстрагировали с помощью TRIzol, а кДНК синтезировали с использованием праймера олиго (dT) только для амплификации мРНК. АО2 снова использовали в качестве маркера для макрогамет, и ожидаемый продукт ПЦР составляет 218 п.н. Для оценки наличия микрогаметы мы выбрали ген TgME49_306338, который сверхэкспрессируется на стадии гамет, соответствует 7-му дню после инфицирования у кошек [12] и на 44% идентичен белку, экспрессируемому в жгутиках подвижных зеленых водорослей C . Reinhardtii . Ожидаемый продукт ПЦР для TgME49_306338 составляет 160 п.н. TUB1A использовали в качестве входного контроля, и в результате был получен продукт длиной 172 пар оснований. «Нет RT» соответствует реакции синтеза кДНК без добавления RT в качестве контроля загрязнения геномной ДНК. Эквивалентные количества кДНК на образец использовали в качестве матрицы для каждой реакции ПЦР, и продукты разделяли на акриламидном геле. Полосы правильного размера, показывающие экспрессию AO2 и TgME49_306338, наблюдались только в монослоях, дополненных линолевой кислотой.(h) Количество положительных стенок ооцисты, окрашенных 3G4, определяли количественно. Монослои кишечника кошек инфицировали Т . gondii брадизоитов и через 7 дней фиксировали 3,7% формальдегидом в PBS и инкубировали с 3G4, как показано на (e, f и g). Количество положительных стенок ооцист подсчитывали на каждом слайде и делили на площадь слайда в см 2 . Количество положительных стенок ооцист в монослоях с добавлением линолевой кислоты было значительно выше, чем в монослоях с добавлением олеиновой кислоты в трех биологических повторностях.* p -значение = 0,0272 с N = 3 по двустороннему непарному тесту t . АО2, аминоксидаза, медьсодержащий белок 2; ДИК – дифференциально-интерференционный контраст; IgM, иммуноглобулин M; RT – обратная транскриптаза; ТУБ1А, тубулин 1А.
https://doi.org/10.1371/journal.pbio.3000364.g003
Ингибирование дельта-6-десатуразы вызывает половое развитие в клеточных культурах мышиных клеток
Зависимость Т . gondii половое развитие при высоком уровне линолевой кислоты было интригующим, потому что кошки – единственные известные млекопитающие, у которых отсутствует активность дельта-6-десатуразы в тонком кишечнике [13,14].Дельта-6-десатураза является первой и лимитирующей стадией превращения линолевой кислоты в арахидоновую кислоту. Линолевая кислота является доминирующей жирной кислотой в сыворотке кошек, составляя 25–46% от общего количества жирных кислот [15–18], тогда как сыворотка грызунов содержит только 3–10% линолевой кислоты [19–22]. Мы предположили, что отсутствие активности дельта-6-десатуразы в тонком кишечнике кошек позволяет накапливать линолевую кислоту из рациона, которая затем действует как положительный сигнал для T . gondii половое развитие.Чтобы проверить эту гипотезу, мы инфицировали монослои кишечника мыши с T . gondii и дополнили их линолевой кислотой и химическим веществом SC-26196, специфическим ингибитором фермента дельта-6-десатуразы, для установления высоких стабильных уровней линолевой кислоты [23]. Через пять дней после заражения культуры мышей T . gondii оценивали маркеры мерозоитов BRP1 [7] и GRA11B [6]. Мы обнаружили экспрессию GRA11B и BRP1 в клетках кишечника мышей только при добавлении линолевой кислоты и SC-26196 (рис. 4).Эти данные предполагают, что фермент дельта-6-десатураза должен быть ингибирован для того, чтобы достаточно высокие уровни экзогенной линолевой кислоты увеличились и индуцировали T . gondii половое развитие в клетках кишечника не кошачьих. Подобно клеткам кошек, монослои кишечника мышей, дополненные как линолевой кислотой, так и SC-26196, содержали приблизительно 26% от T . gondii вакуолей, экспрессирующих как BRP1, так и GRA11B (фиг. S1, данные S4).
Рис. 4. Ингибирование дельта-6-десатуразы способствует половому развитию в культуре мышей.
Монослои кишечника мышей инкубировали либо (a) без добавления жирных кислот, (b) 200 мкМ линолевой кислоты, либо (c, d, e) 200 мкМ линолевой кислоты плюс ингибитор дельта-6-десатуразы («D6D inh. ”) SC-26196 в течение 24 часов, а затем инфицировали брадизоитами ME49 в течение 5 дней. Только в культурах с добавлением линолевой кислоты и SC-26196 паразиты, подвергающиеся пресексуальному развитию, были обнаружены путем окрашивания GRA11B (красный) или BRP1 (зеленый). Паразиты на (в) ранней, (г) средней или (д) поздней стадиях развития были отмечены по дифференциальной локализации GRA11B.Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. BRP1, брадизоит роптрийный белок-1; ДИК – дифференциально-интерференционный контраст; GRA11B, плотные гранулы белка 11B.
https://doi.org/10.1371/journal.pbio.3000364.g004
Ингибирование дельта-6-десатуразы вызывает половое развитие у живых мышей
Ооцисты, выделяемые с фекалиями кошек, должны пройти процесс споруляции, чтобы стать заразными для следующего хозяина. Мы попытались спорулировать круглые структуры, содержащие антиген стенки ооцисты, которые были получены либо от кошачьих, либо от ингибированных культивированных клеток кишечника мыши при комнатной температуре с аэрозолизацией в течение 7–14 дней.К сожалению, из монослоев было получено мало структур, они, по-видимому, не спорулировали, и они не были инфекционными для мышей. Мы предположили, что T . gondii Развитие ооцисты и инфекционность потребуют физиологических условий у всего животного, которые не могут быть воспроизведены в культуре ткани. Чтобы проверить эту гипотезу, мы подавили активность дельта-6-десатуразы в кишечнике живых мышей. Ингибитор дельта-6-десатуразы SC-26196 эффективен в качестве противовоспалительного агента в экспериментах на животных [24].Поскольку ранее было замечено, что спорозоиты перешли в быстро воспроизводящуюся бесполую стадию, называемую тахизоитом, в течение 8 часов после пероральной инокуляции крысам [25] мы кормили мышей рационом, богатым линолевой кислотой, и предварительно обрабатывали их дельта-6-десатуразой. ингибитор SC-26196 (или контроль без ингибитора) за 12 часов до перорального инфицирования T . gondii и каждые 12 часов после этого. У мышей, получавших как диету, богатую линолевой кислотой, так и ингибитор SC-26196, через 7 дней после заражения количественная ПЦР (qPCR) кДНК подвздошной кишки показала высокую экспрессию T . gondii маркер мерозоитов GRA11B и низкая экспрессия бесполого тахизоитного поверхностного антигена 1 (SAG1) [26] (рис. 5a, данные S5). Срезы подвздошной кишки на 7 день после инфицирования заливали парафином и окрашивали гематоксилином и эозином или ретикулином. Пресексуальная и ранняя стадии ооцист присутствовали только в ткани мышей, получавших линолевую кислоту и ингибитор дельта-6-десатуразы (рис. 5b и 5c).
Рис. 5. Мыши выделяют ооцисты после ингибирования D6D.
Мышам вводили через желудочный зонд LA и ингибитор D6D («Inh.”) SC-26196 за 12 часов до заражения брадизоитами ME49, а затем каждые 12 часов в течение 7 дней заражения. (а) КПЦР кДНК из подвздошной кишки для тахизоитного маркера SAG1 (черный) и GRA11B (красный) показывает, что GRA11B значительно повышается только в присутствии SC-26196 (значение p = 0,0057 с N = 2 двусторонним непарным тестом t ). (b) Срезы подвздошной кишки на 7 день после инфицирования заливали парафином и окрашивали гематоксилином и эозином для визуализации пресексуальных стадий.(c) Ранние внутриклеточные ооцисты наблюдались в подвздошной кишке D6D-ингибированных мышей, пропитанных серебром (ретикулиновое окрашивание) и сфотографированных с использованием дифференциальной контрастной визуализации, чтобы очертить стенку ооцисты в темно-коричневом цвете [27]; Черная полоса размером 10 мкм в правом нижнем углу. (d) Свежие ооцисты фиксировали в 3,7% формальдегиде в суспензии, инкубировали с мышиным моноклональным антителом 3G4 в течение ночи, а затем инкубировали с козьим антимышиным вторичным антителом Alexa Fluor 488. Панели имеют размер 20 мкм 2 с полосой белого размера 5 мкм в правом нижнем углу.D6D, дельта-6-десатураза; ДИК – дифференциально-интерференционный контраст; ЖК, жирная кислота; GRA11B, плотные гранулы белка 11B; LA, линолевая кислота; qPCR, количественная ПЦР; SAG1, поверхностный антиген 1.
https://doi.org/10.1371/journal.pbio.3000364.g005
Уже на 6 день после инфицирования в кале мышей присутствовали ооцистоподобные структуры, показывающие позитивное окрашивание на антитела 3G4 (рис. 5d), и их количество увеличивалось в число до 7-го дня, когда мышей умерщвляли. КПЦР на геномной ДНК из образцов фекалий мышей показала, что T .Геномная ДНК gondii была обнаружена только у мышей, получавших SC-26196 (рис. 6a, данные S6), что указывает на то, что дельта-6-десатураза должна быть инактивирована у мышей для T . gondii половых стадий развития в кишечнике мыши. Мыши продуцировали 1000–10 000 ооцист на грамм сухих фекалий. Для увеличения количества и продолжительности выделения ооцист мышам давали ингибитор SC-26196 каждые 12 часов только до 5 дня после инфицирования. Ооцисты контролировали в фекалиях, пик выделения приходился на 8-9 дни с содержанием от 100 000 до 150 000 ооцист / грамм сухих фекалий (рис. 6b, данные S7), что находится в пределах диапазона, наблюдаемого для кошек (2 000–1 500 000 ооцист / грамм). фекалий [3,4]).
Рис. 6. Ооцисты мыши заразны.
(a) КПЦР геномной ДНК из образцов фекалий мышей показывает, что T . Геномная ДНК gondii обнаруживается только у мышей, получавших SC-26196 (значение p = 0,0002 с N = 3 по двустороннему непарному тесту t ). (b) Подсчет количества ооцист на грамм фекалий с течением времени. *** p -значение = 0,0003 день 5 по сравнению с 8 и ** p -значение = 0,0017 день 9 по сравнению с 14. (c) Через 7 дней в условиях споруляции спороцисты были видны с помощью DIC, а синяя автофлуоресценция стенки ооцисты были усилены.Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. (d) Для воздействия на стенку спороцисты антитела 4B6 [11] спорулированные ооцисты сушили на предметных стеклах, фиксировали и пропитывали холодным ацетоном в течение 30 минут, инкубировали с мышиным моноклональным антителом 4B6 в течение ночи, а затем инкубировали с козьими анти- вторичное антитело мыши Alexa Fluor 488. (e) Через 28 дней ИП с ооцистами T . gondii цисты были выделены из мозга мышей и обнаружены с помощью DBA [28] (красный).Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. D6D Inh., Ингибитор дельта-6-десатуразы; DBA, Dolichos biflorus агглютинин; ДИК – дифференциально-интерференционный контраст; ЖК, жирная кислота; LA, линолевая кислота; ИП – постинфекция; КПЦР, количественная ПЦР.
https://doi.org/10.1371/journal.pbio.3000364.g006
Ооцисты, полученные от мышей, спорулируют и являются инфекционными
Т . gondii ооцисты подвержены высыханию, что делает их неспособными к споруляции [29].Поэтому фекалии мышей или содержимое кишечника немедленно помещали в физиологический раствор и спорулировали при комнатной температуре с аэрозолизацией. Ооцисты кошачьего происхождения обычно стабильны после 30-минутной инкубации в неразбавленном отбеливателе (5% гипохлорита натрия) и длительной инкубации в 2% серной кислоте [5]. Поскольку ооцисты, полученные от мышей, не были столь устойчивы к отбеливателю и 2% -ной серной кислоте, как ооцисты кошачьих, они спорулировали в физиологическом растворе с антибиотиками. Через 7 дней споруляция была очевидна примерно в 50% ооцист при визуализации спорозоитов, темно-синей аутофлуоресцентной стенки [30] (рис. 6c) и реактивности с антителом 4B6, которое распознает две отдельные спороцисты в ооцистах [11]. (Рис 6d).Спорулированные ооцисты были инфекционными для мышей, что видно по конверсии сыворотки (S2 фиг.) И цистам в головном мозге через 28 дней (фиг. 6e, S3 фиг.). Подобно ооцистам, полученным от кошек, эти спорулированные ооцисты мыши были стабильными и заразными в течение не менее 3 месяцев при хранении при 4 ° C.
Заключительные замечания
В совокупности эти результаты определяют механизм видовой специфичности для T . gondii полового развития и показывают, что видовой барьер может быть преодолен для T . gondii половое развитие путем ингибирования активности дельта-6-десатуразы в кишечнике хозяина, отличного от кошачьего. Отсутствие активности дельта-6-десатуразы и накопление линолевой кислоты, вероятно, увеличивает T . gondii половое развитие несколькими путями. Во-первых, предыдущие исследования предполагают, что линолевая кислота цитотоксична для стадии бесполых тахизоитов [31]; таким образом, развитие тахизоитов будет остановлено в среде, богатой линолевой кислотой. Во-вторых, ингибирование дельта-6-десатуразы, вероятно, снижает уровень арахидоновой кислоты, что может изменить выработку иммунных липидных медиаторов, известных как эйкозаноиды.Наконец, резкое различие между олеиновой кислотой с одной двойной связью и линолевой кислотой с двумя показателями того, что линолевая кислота, вероятно, используется в качестве сигнальной молекулы, а не для удовлетворения основных потребностей в питании. Чувствительность кворума к половому размножению у грибов зависит от оксигенации линолевой кислоты, но не олеиновой кислоты [9]. Множественный хост и T . gondii циклооксигеназы и липоксигеназы могут оксигенировать линолевую кислоту до сигнальной молекулы оксилипина для T . gondii продолжается половое развитие. Другие простейшие паразиты также полагаются на липиды, полученные от хозяина, которые могут использоваться как сигнальные молекулы, а также как источники липидов для роста паразитов в течение их жизненных циклов [32,33].
Материалы и методы
Заявление об этике
Мышей лечили в соответствии с руководящими принципами, установленными Комитетом по уходу и использованию животных (IACUC) Школы медицины и общественного здравоохранения Университета Висконсина (протокол № M005217).Кошек лечили в соответствии с руководящими принципами, установленными IACUC Министерства сельского хозяйства США, район Белтсвилл (протокол № 15–017). Оба учреждения придерживаются правил и руководств, установленных Национальным исследовательским советом.
Органоиды кишечника
Органоиды кишечника кошек были выделены из срезов тощей кишки, полученных из срезов тонкой кишки плода. Органоиды кишечника мышей получали из срезов тощей кишки мышей-самцов C57BL / 6J в возрасте 8 недель.Органоиды были получены, как описано ранее [34]. Вкратце, срезы кишечника промывали ледяным PBS, содержащим 0,1 мг / мл стрептомицина и 100 Ед / мл пенициллина, в течение 20 минут. Последовательно добавляли EDTA (Sigma) до конечной концентрации 2 мМ и ткань инкубировали в течение 40 минут при 4 ° C. Затем ткань промывали холодным PBS без EDTA и энергично встряхивали до тех пор, пока в супернатанте не стали видны крипты. Суспензию крипт фильтровали с использованием сетчатого фильтра для клеток 70 мкм, и крипты центрифугировали при 80 g в течение 5 минут.Клетки ресуспендировали в Matrigel (BD Biosciences), переносили пипеткой в 24-луночный планшет, позволяли полимеризоваться и затем покрывали органоидной средой. Органоидная среда содержит Advanced DMEM / F12 с 2 мМ глутамакса, 20 мМ HEPES, 1 × B27, 1 × N2, 10% об. / Об. Фетальной бычьей сыворотки, 10 мг / л инсулина, 5,5 мг / л трансферрина, 0,67 мг / л. селенит, пенициллин и стрептомицин (все от Invitrogen), 50 нг / мл человеческого EGF (R&D systems), 10 мМ никотинамид (Sigma), 3 мкМ CHIR99021 и 10 мкМ Y-27632 (оба Selleckchem), и 50% об. / об. кондиционированных среда, полученная из клеточной линии L-WRN (ATCC CRL 3276).Среду меняли через день, и органоиды увеличивали, пропуская клетки через иглу 25-го размера каждую неделю. Все эксперименты проводились с клетками со 2 по 5 пассаж, и клетки регулярно проверялись на загрязнение микоплазмой (MicoAlert Lonza).
Кишечные монослои и добавление жирных кислот
Монослои были получены из органоидов кишечника, как описано ранее [35]. Вкратце, установленные органоиды кишечника кошек или мышей промывали холодным PBS, расщепляли 0.05% m / v трипсина в течение 5 минут при 37 ° C, центрифугировали при 250 g в течение 3 минут и ресуспендировали в свежей предварительно нагретой органоидной среде. Клеточную суспензию добавляли на предметное стекло (Thermo), предварительно покрытое энтактин-коллагеном IV-ламинином (Corning) для кошачьих клеток или 2% м / об. Желатина в PBS (Sigma) для мышиных клеток. Слайды покрывали сушкой на воздухе матрицы базальной мембраны или желатина до сушки на воздухе в течение ночи. Монослои выращивали в течение 10–15 дней до заражения T . gondii брадизоитов со сменой среды через день, пока клетки не достигнут 90% или более слияния.Линолевая кислота или олеиновая кислота, конъюгированная с BSA (Sigma), добавлялась к монослоям органоидов до 0,2 мМ за 24 часа до инфицирования.
Приготовление и заражение брадизоитом
мышей C57BL / 6J через желудочный зонд инфицировали 500–1000 ооцист ME49 из кошачьих фекалий. Через 28 дней после заражения мозг удаляли, промывали холодным PBS и гомогенизировали с помощью измельчителя стеклянных тканей. Суспензию центрифугировали при 400 g в течение 10 минут и осадок суспендировали в 20% мас. / Об. Декстране (средний молекулярный вес 150 000, Sigma).Кисты брадизоита осаждали и отделяли от материала мозга центрифугированием при 2200 g в течение 10 минут. Осадок промывали PBS, расщепляли 0,1 мг / мл пепсина в HCl в течение 5 минут при 37 ° C, а затем нейтрализовали равным объемом 1% карбоната натрия (Sigma). Брадизоиты центрифугировали при 250, г, в течение 10 минут, ресуспендировали в предварительно нагретой органоидной среде и добавляли к монослоям органоидов с множественностью инфицирования 1 брадизоит: 10 кишечных эпителиальных клеток (MOI 1:10).
Ингибирование дельта-6-десатуразы
SC-26196 (Cayman) солюбилизировали в ДМСО и использовали в концентрации 20 мкМ в монослоях органоидов мыши. Для лечения in vivo ингибитор солюбилизировали в 0,5% м / об метилцеллюлозе, и мышам вводили 50 мг / кг каждые 12 часов через желудочный зонд [24]. Самки мышей C57BL / 6J (возраст 4 недели) с делецией Z-ДНК-связывающего белка [36] были разделены на четыре разные группы: неинфицированный контроль, T . gondii – инфицированы без добавления жирных кислот, T . gondii – заражены добавками линолевой кислоты, а T . gondii – заражен линолевой кислотой и ингибитором SC-26196. Каждая мышь, получавшая добавку линолевой кислоты, получала 10 мкл 99% масла линолевой кислоты (MilliporeSigma Cat # 843483), суспендированного в 0,5% метилцеллюлозе, в день через желудочный зонд. Мышей инфицировали 1000 цист головного мозга, очищенных, как описано выше, через желудочный зонд, и умерщвляли через 7 дней после заражения. Размер выборки составлял не менее двух мышей на группу, и эксперимент повторяли пять раз.Альтернативно, каждую мышь инфицировали мозгом одной мыши по крайней мере через 2 месяца после заражения по крайней мере 1000 цист. Мышей лечили SC-26196 до 5 дня после инфицирования. Фекалии собирали с 5–14 дней, а ооцисты подсчитывали с помощью микроскопии.
Иммунофлуоресценция
Монослои органоидов кишечника или образцы фекалий мышей фиксировали в 3,7% формальдегиде в PBS в течение 20 минут, проницали 0,2% тритоном X-100 (Sigma) в PBS при комнатной температуре в течение 1 часа, а затем блокировали 3% BSA в PBS при температуре комнатная температура в течение 1 часа.Первичные антитела инкубировали при 4 ° C в течение ночи в 0,2% об. / Об. Triton x-100 и 3% BSA в PBS (1: 100 мышиное антитело против GRA11B, 1: 100 кроличье антитело против BRP1, 1: 100 мышиное антитело против AO2, Моноклональные мышиные анти-ZO-1 в соотношении 1:50 [Santa Cruz] или 1:25 мышиные IgM против стенок ооцисты 3G4). Спорулированные ооцисты из фекалий мыши сушили на предметных стеклах, фиксировали и пропитывали ледяным ацетоном в течение 30 минут и инкубировали с 1:20 мышиным 4B6 для визуализации спороцисты. Слайды инкубировали со специфическим вторичным антителом (1: 500 козлиное антитело против кролика Alexa Fluor 488 и 1: 500 козье антитело против мыши Alexa Fluor 594) при комнатной температуре в течение 1 часа, а затем трижды промывали PBS.Ядра клеток окрашивали 10 мкМ DAPI (Sigma). Слайды помещали в среду для фиксации противоэпидемических материалов Vectashield (VectorLabs). Образцы получали на Zeiss Axioplan III, оборудованном трехпроходным (DAPI / флуоресцеинизотиоцианат [FITC] / Texas Red) эмиссионным кубом, оптикой дифференциального интерференционного контраста и монохроматической камерой Axiocam, управляемой программным обеспечением Zen (Zeiss) и обработанной с помощью ImageJ ( Пакет Фиджи).
Срезы тканей и гистология
подвздошной кишки исправлено в 3.7% формальдегида в PBS в течение ночи, залитое в парафин и разделенное лабораторией «Инициативы трансляционных исследований в патологии» Университета Висконсин-Мэдисон. Срезы окрашивали гематоксилином и эозином или ретикулином (серебром).
ПЦР в реальном времени на кДНК подвздошной кишки
Мышей, получавших или не получавших лечение ингибитором дельта-6-десатуразы, умерщвляли через 7 дней после заражения. У каждой мыши удаляли подвздошную кишку и гомогенизировали в 1 мл TRIzol. Тотальную РНК выделяли в соответствии с протоколом производителя (Invitrogen) и обрабатывали ДНКазой I степени амплификации.кДНК генерировали с использованием набора Invitrogen SuperScript III First-Strand Synthesis со случайными гексамерными праймерами. GRA11B и SAG1 использовались как маркеры половой и бесполой стадий соответственно. Модель T . gondii ген домашнего хозяйства TUB1A использовали для нормализации экспрессии целевого гена. КПЦР в реальном времени выполняли с использованием Supermix Bio-Rad iTaq Universal SYBR Green в системе Applied Biosystems StepOnePlus Real-Time PCR. Эффективность каждого набора праймеров рассчитывалась по наклону стандартной кривой разведения тахизоитной гДНК 1:10, где E = 10 ^ (-1 / наклон).Затем метод Pfaffl [37], который учитывает различия в эффективности, был использован для расчета относительной экспрессии генов GRA11B и SAG1 на образец в трех экземплярах. Использовали только лунки с одной температурой кривой плавления, что указывает на один продукт. Последовательности праймеров были следующими:
- TUB1A вперед: 5 ′ –GACGACGCCTTCAACACCTTCTTT– 3 ′
- Реверс: 5 ′ –AGTTGTTCGCAGCATCCTCTTTCC– 3 ′
- SAG1 вперед: 5 ′ –TGCCCAGCGGGTACTACAAG– 3 ′
- Реверс: 5 ′ –TGCCGTGTCGAGACTAGCAG– 3 ′
- GRA11B вперед: 5 ′ –ATCAAGTCGCACGAGACGCC– 3 ′
- Реверс: 5 ′ –AGCGAATTGCGTTCCCTGCT– 3 ′
ПЦР в реальном времени для
T . gondii геномная ДНК в образцах фекалий Было собранообразцов фекалий мышей с обработкой ингибитором дельта-6-десатуразы и без нее. Геномную ДНК генерировали из 0,1 г фекалий каждой мыши с использованием набора для ДНК почвы (QIAGEN) в соответствии с инструкциями производителя, за исключением того, что клетки разрушали взбивателем для шариков вместо вихря. Стандартная кривая была построена с использованием серии разведений из 10 1 –10 5 паразитов на лунку, амплифицированную с использованием набора праймеров SAG1, описанного выше, на основе образца геномной ДНК с известным количеством паразитов.Значения Ct наносили на график числа паразитов. Число копий гена-мишени в каждом образце можно интерполировать из линейной регрессии стандартной кривой.
ПЦР в реальном времени выполняли для каждого образца в трех экземплярах с использованием Bio-Rad iTaq Universal SYBR Green Supermix в системе Applied Biosystems StepOnePlus Real-Time PCR. Рассчитанные числа копий каждого образца были нормализованы на основе нг нуклеиновой кислоты, используемой в качестве матрицы ПЦР. Использовали только лунки с одной температурой кривой плавления, что указывает на один продукт.
ПЦР монослоев кишечника кошек
Монослои кишечника кошек выращивали в 24-луночных планшетах до слияния, а затем инкубировали либо без добавления жирных кислот, либо с 200 мкМ олеиновой кислотой, либо с 200 мкМ линолевой кислотой в течение 24 часов. Монослои инфицировали брадизоитами ME49, очищенными из мозга хронически инфицированных мышей, в двух экземплярах с неинфицированными монослоями в качестве отрицательного контроля. Через семь дней после заражения РНК экстрагировали TRIzol и кДНК синтезировали, как описано выше.TgAO2 использовали в качестве маркера для макрогамет, а TgME49_306338 использовали в качестве маркера для микрогамет. TUB1A использовали в качестве входного контроля с использованием тех же праймеров, что и выше. Реакцию синтеза кДНК без добавления обратной транскриптазы использовали в качестве контроля загрязнения геномной ДНК. Эквивалентные количества кДНК на образец использовали в качестве матрицы для каждой реакции ПЦР, и продукты разделяли на акриламидном геле и отображали. Последовательности праймеров были следующими:
- TgAO2 вперед: 5 ′ –GTCTTGGTTCGTTGAAGGGGCTG– 3 ′
- Реверс: 5 ′ –CGTCCTCGATGCCCATGAAATCTG– 3 ′
- TgME49_306338 вперед: 5 ′ –CCACGTCCTTCGCCGATG– 3 ′
- Реверс: 5 ′ –CATCAGAGGTCCCAGGTTGTCG– 3 ′
Статистические методы
Все пробы кала с помощью ПЦР в реальном времени были проанализированы в трех технических повторностях.Разницу между средним числом копий целевого гена анализировали с помощью двусторонних непарных тестов t . Образцы кишечника с помощью ПЦР в реальном времени запускали в трех повторностях из двух биологических повторностей на группу. Разницу между средней относительной экспрессией каждого целевого гена анализировали с помощью двусторонних непарных тестов t .
Споруляция ооцист и инфекции мышей
Свежие образцы фекалий получали от каждой мыши, гомогенизировали в PBS, а затем центрифугировали при 1500 g .Осадок ресуспендировали в PBS плюс пенициллин и стрептомицин, и образцы встряхивали в течение 7–14 дней при комнатной температуре в присутствии кислорода. Ооцисты мышей были стабильны не менее 3 месяцев при 4 ° C. Наивные мыши были инфицированы приблизительно 250 мышиными ооцистами посредством внутрибрюшинной инъекции. Мышей гуманно умерщвляли на 28 день после заражения, и их мозг удаляли, гомогенизировали и либо инкубировали с биотинилированным DBA 1: 1000, либо очищали с 20% m / v декстраном, как описано выше, перед инкубацией DBA.Затем все цисты инкубировали со стрептавидин-конъюгированным Alexa Fluor-594 1: 1000 и отображали на Zeiss Axioplan III, оборудованном трехпроходным (DAPI / FITC / Texas Red) эмиссионным кубом, оптикой с дифференциальным интерференционным контрастом и монохроматической камерой Axiocam. программой Zen (Zeiss) и обработаны с помощью ImageJ (пакет Fiji).
Вестерн иммуноблот
Лизаты тахизоитовME49 обрабатывали 15% -ным SDS-PAGE белковым гелем, переносили на нитроцеллюлозную мембрану и блокировали полоски 5% мас. / Об. Обезжиренным молоком в TBS 1.0% об. / Об. Твин-20. Собранную сыворотку разводили 1: 250 TBS, 1,0% об. / Об. Tween-20, и использовали 1: 2000 антимышиных HRP в качестве вторичных антител. Сыворотку мышей C57BL / 6, инфицированных кошачьими ооцистами в течение 26 дней, использовали в качестве положительного контроля, а сыворотку от неинфицированных мышей C57BL / 6 использовали в качестве отрицательного контроля. Полоски получали с помощью LI-COR (LI-COR Biosciences) при 700 нм или хемилюминесценции в течение 5-минутной экспозиции.
Дополнительная информация
S1 Рис. Количественное определение мерозоитов в культуре ткани мышей.
Органоиды кишечника мышей диссоциировали под действием трипсина, и отдельные клетки выращивали на предметных стеклах. Слайды были разделены на три разные группы: без добавления жирных кислот или ингибитора SC-26196, с добавлением 200 мкМ линолевой кислоты или с добавлением 200 мкМ линолевой кислоты и 20 мкМ SC-26196 («D6D + LA»). Монослои были инфицированы T . gondii брадизоиты ME49 очищены из мозга хронически инфицированных мышей. Через 5 дней после заражения монослои окрашивали на GRA11B, BRP1 и DAPI.Общее количество паразитофорных вакуолей подсчитывали с помощью положительного окрашивания DAPI и подтверждали морфологией с помощью DIC. Определяли процент вакуолей, положительных по GRA11B и BRP1, от общего количества вакуолей. Было подсчитано три биологических повтора, и в среднем 26% всех вакуолей были положительными по GRA11B и BRP1 в монослоях, дополненных линолевой кислотой с добавлением SC-26196. ** p -значение = 0,0039 с N = 3 по двустороннему непарному тесту t .BRP1, брадизоит роптрийный белок-1; ДИК – дифференциально-интерференционный контраст; GRA11B, плотные гранулы белка 11B.
https://doi.org/10.1371/journal.pbio.3000364.s001
(TIF)
S2 Рис. Оценка инфекционности ооцист мышей по конверсии сыворотки.
Ооцисты, собранные у мышей, обработанных SC-26196, спорулировали и вводили внутрибрюшинно мышам C57BL / 6. Сыворотку собирали путем терминального кровотечения либо через 22 дня (1 и 2), либо через 28 дней (3 и 4), либо через 3 месяца (5–10) после инфицирования.Сыворотка неинфицированной мыши использовалась в качестве отрицательного контроля (-). Положительный контроль (+) представлял собой сыворотку от мыши, инфицированной в течение 26 дней ооцистами кошки. Сыворотку инкубировали с нитроцеллюлозой, обработанной лизатом тахизоита ME49. Панель (а) представляет собой хемилюминесценцию, а (б) представляет собой изображение при длине волны 700 нм, показывающее отдельные дорожки и лестницу белка.
https://doi.org/10.1371/journal.pbio.3000364.s002
(TIF)
S3 Рис. Ооцисты мыши заразны.
Через двадцать восемь дней после заражения ооцистами мозг мыши удаляли, гомогенизировали и окрашивали на T . gondii кисты по DBA (красные). Все панели имеют размер 20 мкм 2 с белой полосой размером 5 мкм в правом нижнем углу. DBA, D . biflorus агглютинин.
https://doi.org/10.1371/journal.pbio.3000364.s003
(TIF)
S1 Данные. Исходные данные для рис. 2а.
Количественная оценка двойных положительных вакуолей GRA11B и BRP1 в культуре тканей кошек. Монослои кишечника кошек были разделены на три разные группы: без добавления жирных кислот, с добавлением 200 мкМ олеиновой кислоты или с добавлением 200 мкМ линолевой кислоты (левый столбец).Монослои были инфицированы T . gondii брадизоиты ME49, очищенные из мозга мышей с хронической инфекцией при MOI 1:10. Через пять дней после заражения проводили окрашивание на GRA11B и BRP1 вместе с DAPI. Для каждого случайного поля подсчитывали количество ядер клетки-хозяина вместе с двойными положительными и отрицательными вакуолями GRA11B / BRP1. Для каждого биологического повтора было подсчитано пять различных технических повторов, и представлено среднее значение. Каждая строка таблицы представляет собой независимый эксперимент, три биологические повторы.BRP1, брадизоит роптрийный белок-1; GRA11B, плотные гранулы белка 11B; MOI, множественность заражения.
https://doi.org/10.1371/journal.pbio.3000364.s004
(TIF)
S2 Данные. Исходные данные для рис. 2б.
Необработанные значения Ct TUB1A, SAG1 и GRA11B из кДНК образцов монослоев кишечника кошек с использованием TUB1A в качестве нормализатора для экспрессии целевого гена. Лунки с несколькими температурами кривой плавления, указывающими на нецелевые продукты, были исключены («NA»). Образцы с пределом обнаружения ниже 40 циклов помечаются как BDL.BRP1, брадизоит роптрийный белок-1; GRA11B, плотные гранулы белка 11B; SAG1, поверхностный антиген 1; ТУБ1А, тубулин 1А.
https://doi.org/10.1371/journal.pbio.3000364.s005
(TIF)
S3 Данные. Исходные данные для рис. 3h.
Количественное определение вакуолей, положительных на антитело 3G4 стенки ооцисты в культуре ткани кошки. Монослои кишечника кошек были разделены на три разные группы: без добавления жирных кислот, с добавлением 200 мкМ олеиновой кислоты или с добавлением 200 мкМ линолевой кислоты (левый столбец).Монослои были инфицированы T . gondii брадизоиты ME49, очищенные из мозга мышей с хронической инфекцией при MOI 1:10. Через семь дней после заражения проводили окрашивание на антиген стенки ооцисты антителом 3G4. Для каждой лунки размером 1 см 2 подсчитывали общее количество 3G4-положительных вакуолей. Каждый столбец таблицы представляет собой независимый эксперимент, три биологические повторы. MOI, множественность заражения.
https://doi.org/10.1371/journal.pbio.3000364.s006
(TIF)
S4 Данные. Необработанные данные для S1 Рис.
Количественная оценка двойных положительных вакуолей GRA11B и BRP1 в культуре ткани мышей. Монослои кишечника мышей были разделены на три разные группы: без добавления жирных кислот или ингибитора SC-26196 (без жирной кислоты), с добавлением 200 мкМ линолевой кислоты или с добавлением 200 мкМ линолевой кислоты с добавлением 20 мкМ SC-26196 ( «D6D inh.»). Монослои были инфицированы T . gondii брадизоиты ME49, очищенные из мозга мышей с хронической инфекцией при MOI 1:10.Через пять дней после заражения проводили окрашивание на GRA11B и BRP1 вместе с DAPI. Для каждого случайного поля подсчитывали количество ядер клетки-хозяина вместе с двойными положительными и отрицательными вакуолями GRA11B / BRP1. Для каждой биологической реплики было подсчитано три различных технических повтора, и представлено среднее значение. Каждая строка таблицы представляет собой независимый эксперимент, три биологические повторы. BRP1, брадизоит роптрийный белок-1; GRA11B, плотные гранулы белка 11B; MOI, множественность заражения.
https://doi.org/10.1371/journal.pbio.3000364.s007
(TIF)
S5 Данные. Исходные данные для рис. 5а.
Исходные значения Ct стандартных кривых TUB1A, SAG1 и GRA11B в серии разведений геномной ДНК из тахизоитов и исходные значения Ct TUB1A, SAG1 и GRA11B из кДНК гомогенизированных образцов подвздошной кишки мыши с использованием TUB1A в качестве нормализатора для мишени экспрессия гена. Лунки с несколькими температурами кривой плавления, указывающими на нецелевые продукты, были исключены («NA»).Образцы с пределом обнаружения ниже 40 циклов помечаются как BDL. BRP1, брадизоит роптрийный белок-1; GRA11B, плотные гранулы белка 11B; SAG1, поверхностный антиген 1; ТУБ1А, тубулин 1А.
https://doi.org/10.1371/journal.pbio.3000364.s008
(TIF)
S6 Данные. Исходные данные для рис. 6а.
Необработанные значения Ct стандартной кривой SAG1 в серии разведений геномной ДНК с известным количеством паразитов и исходные значения Ct амплификации SAG1 из геномной ДНК неизвестных образцов фекалий с использованием введенного количества нг в качестве нормализатора.Лунки с несколькими температурами кривой плавления, указывающими на нецелевые продукты, были исключены («NA»). SAG1, поверхностный антиген 1.
https://doi.org/10.1371/journal.pbio.3000364.s009
(TIF)
Данные S7. Исходные данные для рис. 6б.
Фекалии (0,5 г) солюбилизировали в 500 мкл физиологического раствора, а затем 10 мкл этой суспензии подсчитывали в гемоцитометре. Значения в таблице представляют собой количество ооцист на образец. Каждый столбец таблицы представляет собой независимый эксперимент, три биологические повторы.Среднее количество на d.p.i. были использованы для расчета количества ооцист / грамм кала. d.p.i., через день после заражения.
https://doi.org/10.1371/journal.pbio.3000364.s010
(TIF)
Благодарности
Мы искренне благодарим Джейсона Спенса и его лабораторию за помощь в культуре кишечных органоидов; Орелиен Дюметр, Адриан Хель и Джон Бутройд для специфических для кошачьих стадий антител; Марии Арендт за помощь в создании изображений патологии кишечника; Хизер Фриц, Дэвид Фергюсон и Жан-Франсуа Дюбремец за советом; и Кристине Халл, Бенджамину Розенталю и Родни Уэлчу за редактирование рукописи.
Список литературы
- 1. Дубей Дж. П., Миллер Н. Л., Френкель Дж. Ооциста Toxoplasma gondii из кошачьих фекалий. Дж Опыт . Мед . 1970; 132: 636–662. pmid: 48
- 2. Дубей Дж. П., Френкель Дж. Кисто-индуцированный токсоплазмоз у кошек. J Protozool 1972; 19: 155–177. pmid: 5008846
- 3. Дабриц HA, Конрад PA. Кошки и токсоплазма : значение для общественного здравоохранения. Здравоохранение по зоонозам .2010; 57: 34–52. pmid: 19744306
- 4.
Зулпо Д.Л., Самми А.С., Дос Сантос Дж. Р., Сассе Дж. П., Мартинс Т.А., Минутти А.Ф. и др., Toxoplasma gondii : исследование повторного выделения ооцист у домашних кошек. Ветеринарный Паразитол . 2018; 249: 17–20. pmid: 2
81
- 5. Дубей JP. Токсоплазмоз животных и человека. 2-е изд. Бока-Ратон, Флорида: CRC Press; 2010. С. 1–313.
- 6. Рамакришнан С., Уокер Р.А., Эйхенбергер М., Хел А.Б., Смит, штат Северная Каролина. Мерозоит-специфический белок, TgGRA11B, идентифицирован как компонент паразитофорной вакуоли Toxoplasma gondii в модели экспрессии тахизоитов. Инт Дж Паразит . 2017; 47: 597–600.
- 7. Schwarz JA, Fouts AE, Cummings CA, Ferguson DJ, Boothroyd JC. Новый белок rhoptry в Toxoplasma gondii брадизоитах и мерозоитах. Мол . Биохим . Паразитол . 2005. 144: 159–66. pmid: 16182390
- 8. Нолан С.Дж., Романо Д.Д., Коппенс I. Капельки липидов хозяина: важный источник липидов, спасаемых внутриклеточным паразитом Toxoplasma gondii . Путь PLoS . 2017; 13: e1006362.
- 9. Браун С.Х., Зарновски Р., Шарпи В.С., Келлер Н.П. Морфологические переходы, регулируемые плотностной зависимостью и активностью липоксигеназы в Aspergillus flavus . Appl Environ Microbiol . 2008. 74: 185674–5685.
- 10. Уокер Р.А., Шарман П.А., Миллер С.М., Липпунер С., Оконевски М., Эйхенбергер Р.М. и др. Анализ последовательности РНК транскриптома гаметоцитов Eimeria tenella раскрывает молекулярные основы полового размножения и биогенеза ооцист. ВМС Геномикс . 2015; 16: 1–20.
- 11. Dumètre A, Dardé ML. Иммуномагнитное разделение ооцист Toxoplasma gondii с использованием моноклональных антител, направленных против стенки ооцисты. Дж. Микробиологические методы . 2005; 61: 209–17. pmid: 15722147
- 12. Hehl A, Basso WU, Lippuner C, Ramakrishnan C, Okoniewski M, Walker RA и др. Бесполое распространение мерозоитов Toxoplasma gondii отличается от тахизоитов и влечет за собой экспрессию неперекрывающихся семейств генов для прикрепления, вторжения и репликации в энтероцитах кошек. BMC Genomics 2015; 16: 66 pmid: 25757795
- 13. Реки JPW, Синклер AJ, Кроуфорд Массачусетс. Неспособность кошки обесцвечивать незаменимые жирные кислоты. Природа . 1975. 258: 171–173. pmid: 1186900
- 14. Синклер AJ, Маклин JG, Monger EA. Метаболизм линолевой кислоты у кошек. Липиды . 1979; 14: 932–936. pmid: 513981
- 15. Макдональд М.Л., Роджерс К.Р., Моррис Дж. Г., Роль линолеата как незаменимой жирной кислоты для кошек, не зависящей от синтеза арахидоната. Журнал питания . 1983; 113: 1422–1433. pmid: 6408230
- 16. Trevizan L, de Mello Kessler A, Brenna JT, Lawrence P, Waldron MK, Bauer JE. Поддержание арахидоновой кислоты и свидетельство десатурации Δ5 у кошек, получавших рационы, обогащенные γ-линоленовой и линолевой кислотой. Липиды . 2012; 47: 413–23. pmid: 22249937
- 17. Холл диджей, Фриман Л. М., Раш Д. Е., Каннингем С. М.. Сравнение сывороточных концентраций жирных кислот у кошек с гипертрофической кардиомиопатией и здоровых животных. J Feline Med Surg . 2013; 16: 631–6. pmid: 24366844
- 18. Фудзивара М., Мори Н., Сато Т., Тадзаки Х., Исикава С., Ямамото И. и др. Изменения состава жирных кислот в тканях и сыворотке кошек с ожирением, получавших диету с высоким содержанием жиров. BMC Vet Res . 2015; 11: 1–8.
- 19. Наварро, доктор медицины, Хортелано П., Периаго Д.Л., Пита М.Л. Влияние диетического оливкового и подсолнечного масел на липидный состав аорты и тромбоцитов, а также на эйкозаноиды крови у крыс. Артериосклер Тромб .1992; 12: 830–5. pmid: 1616908
- 20. Адан Ю., Шибата К., Ни В., Цуда Ю., Сато М., Икеда И. и др., Концентрация липидов сыворотки и размер поражения аорты у самок и самцов мышей с дефицитом апо E, получавших докозагексаеновую кислоту. Биоси Биотехнология Биохим . 1999; 6: 309–13.
- 21. Сато М., Сибата К., Номура Р., Кавамото Д., Нагамин Р., Имаидзуми К. Жиры, богатые линолевой кислотой, уменьшают развитие атеросклероза, не считая его эффекта, повышающего окислительный и воспалительный стресс, у мышей с дефицитом аполипопротеина Е по сравнению с жирами, богатыми насыщенными жирными кислотами . Br J Nutr . 2005; 94: 896–901. pmid: 16351765
- 22. Jelińska M, Białek A, Gielecińska I, Mojska H, Tokarz A. Влияние конъюгированной линолевой кислоты, вводимой крысам до и после канцерогенного агента, на метаболиты арахидоновой и линолевой кислоты в сыворотке и опухолях. Prostaglandins Leukot Essent Fatty Acids . 2017; 126: 1–8. pmid: 286
- 23. Obukowicz MG, Welsch DJ, Salsgiver WJ, Martin-Berger CL, Chinn KS, Duffin KL и др., Роман, селективные ингибиторы десатуразы D6 или D5 жирных кислот в качестве противовоспалительных агентов у мышей. Дж Фарм Эксп Терапия . 1998. 287: 157–166.
- 24. He C, Qu X, Wan J, Rong R, Huang L, Cai C. et al. Ингибирование активности дельта-6-десатуразы подавляет рост опухоли у мышей. PLOS ONE . 2012; 7: e47567. pmid: 23112819
- 25. Guiton PS, Sagawa JM, Fritz HM, Boothroyd JC. Модель in vitro кишечной инфекции выявляет регулируемый в процессе развития транскриптом спорозоитов Toxoplasma и сигнатуру NF-κB в инфицированных клетках-хозяевах. PLOS ONE . 2017; 12: e073018.
- 26. Бург Дж. Л., Перельман Д., Каспер Л. Х., Вэр П. Л., Бутройд Дж. Молекулярный анализ гена, кодирующего основной поверхностный антиген Toxoplasma gondii . Дж Иммунол . 1988; 141: 3584–3591. pmid: 3183382
- 27. Дубей Дж. П., Френкель Дж. Кисто-индуцированный токсоплазмоз у кошек. Дж . Протозоол . 1972; 19: 155–177. pmid: 5008846
- 28. Бутройд Дж. С., Блэк М, Боннефой С, Хель А, Нолл Л. Дж., Ясли ID.и др. Генетический и биохимический анализ развития Toxoplasma gondii . Философия Trans R Soc Lond B Biol Sci . 1997; 352: 1347–1354. pmid: 9355126
- 29. Дубей Дж. П., Феррейра Л. Р., Мартинс Дж., Джонс Дж. Л.. Споруляция и выживаемость ооцист Toxoplasma gondii в различных типах коммерческого туалета для кошек. Дж Паразитол . 2011; 97: 751–4. pmid: 21539466
- 30. Белли С.И., Уоллах М.Г., Люксфорд К., Дэвис М.Дж., Смит Северная Каролина.Роль тирозиновых предшественников гликопротеинов и дитирозин- и 3,4-дигидроксифенилаланин-опосредованного сшивания белков в развитии стенки ооцисты кокцидиевого паразита Eimeria maxima . Эукар Ячейка . 2003. 2: 456–464.
- 31. Шамседдин Дж., Ахлаги Л., Размджоу Э., Шоджаи С., Монавари С.Х., Таджикский штат Нью-Джерси. и др. Конъюгированная линолевая кислота стимулирует апоптоз в штаммах RH и Тегеране Toxoplasma gondii in vitro. Иранский Дж. Паразитол .2015; 10: 238–244.
- 32. Толедо DAM, D’Avila H, Melo RCN. Липидные тела хозяина как платформы для внутриклеточного выживания простейших паразитов. Передний . Иммунол . 2016; 7: 1–6.
- 33. Lujan HD, Mowatt MR, Берд LG, Nash TE. Голодание по холестерину вызывает дифференциацию кишечных паразитов Giardia lamblia . Proc . Нац. . Акад. . Научно-исследовательский . 1996; 93: 7628–33. pmid: 8755526
- 34.Мунера Дж.О., Сундарам Н., Рэнкин С.А., Хилл Д., Уотсон С., Маэ М. и др., Дифференциация плюрипотентных стволовых клеток человека в органоиды толстой кишки посредством временной активации передачи сигналов BMP. Стволовые клетки клеток . 2017; 21: 51–64. pmid: 28648364
- 35. Zou WY, Blutt SE, Crawford SE, Ettayebi K, Zeng XL, Saxena K, Ramani S, Karandikar UC, Zachos NC, Estes MK. Кишечные энтероиды человека: новые модели для изучения желудочно-кишечных вирусных инфекций. Методы Мол Биол .Epub 2017 31 марта. Pmid: 28361480
- 36. Питтман К.Дж., Сервантес П.В., Нолл Л.Дж. Z-ДНК-связывающий белок опосредует контроль хозяина инфекции Toxoplasma gondii . Заражение иммунной . 2016; 84: 3063–70. pmid: 27481249
- 37. Pfaffl MW. Новая математическая модель для относительной количественной оценки в RT-PCR в реальном времени. Nucleic Acids Res . 2001; 29: 2002–2007.
Знакомство с вирусами
Знакомство с вирусамиВ 1898 году Фридрих Леффлер и Пауль Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица меньше любых бактерий.Это был первый ключ к разгадке природы вирусов, генетические сущности, которые лежат где-то в серой зоне между живым и неживые состояния.
Вирусы зависят от клеток-хозяев, которые они заражают, для размножения. При обнаружении вне клеток-хозяев вирусы существуют в виде белковой оболочки. или капсид , иногда заключенный в мембрану. Капсид заключает в себе либо ДНК, либо РНК, которая кодирует вирусные элементы. Находясь в этой форме вне клетки, вирус метаболически инертный; примеры таких форм изображены ниже.
Микрофотографии вирусов: Слева электронная микрофотография кластер вирусов гриппа, каждый размером около 100 нанометров (миллиардных долей метра) длинный; видны как мембрана, так и белковая оболочка. Справа микрофотография вируса, вызывающего табачную мозаику. болезнь табачных растений.
Когда вирус вступает в контакт с клеткой-хозяином, он может внедрить свой генетический материал в его хозяина, буквально принимая на себя функции хозяина.An инфицированная клетка производит больше вирусного белка и генетического материала вместо его обычные продукты. Некоторые вирусы могут оставаться в спящем состоянии внутри клеток-хозяев в течение длительные периоды, не вызывая очевидных изменений в их клетках-хозяевах (известная стадия как лизогенная фаза ). Но когда бездействующий вирус стимулируется, он входит в литическую фазу : образуются новые вирусы, самособираются, и вырваться из клетки-хозяина, убивая клетку и продолжая заражать другие клетки.На диаграмме ниже справа показан вирус, который атакует бактерии, известные как лямбда бактериофаг , который измеряет примерно 200 нанометров.
Вирусы вызывают у эукариот ряд заболеваний. У людей при оспе простуда, ветряная оспа, грипп, опоясывающий лишай, герпес, полиомиелит, бешенство, лихорадка Эбола, ханта лихорадка и СПИД – примеры вирусных заболеваний. Даже некоторые виды рака – хотя определенно не все – были связаны с вирусами.
Сами вирусы не имеют палеонтологической летописи, но вполне возможно, что они оставили след в истории жизни. Было высказано предположение, что вирусы может быть причиной некоторых исчезновений, наблюдаемых в окаменелостях запись (Эмилиани, 1993). Некоторые когда-то думали, что вспышки вирусных заболеваний могли быть ответственны за массовые вымирания, такие как вымирание динозавров и других форм жизни. Эту теорию трудно проверить, но она кажется маловероятной, поскольку данный вирус обычно может вызывать заболевание только у одного вида или у группы родственных разновидность.Даже гипотетический вирус, способный заразить и убить всех динозавры 65 миллионов лет назад не могли заразить аммониты или фораминиферы которые вымерли в то же время.
С другой стороны, поскольку вирусы могут передавать генетический материал между различных видов хозяев, они широко используются в генетических инженерное дело. Вирусы также осуществляют естественную «генную инженерию»: вирус может включать в себя некоторый генетический материал от своего хозяина, поскольку он репликация и передача этой генетической информации новому хозяину, даже к хосту, не связанному с предыдущим хостом.Это известно как трансдукция , а в некоторых случаях может служить средством эволюционного изменение – хотя неясно, насколько важна эволюционная механизм трансдукции на самом деле есть.
Изображение вируса гриппа предоставлено отделение ветеринарных наук Королевского университета Белфаста. Изображение вируса табачной мозаики было предоставленный Экспериментальная станция Ротамстед. Оба сервера имеют обширные архивы образов вирусов.
Институт для молекулярной вирусологии в Университете Висконсина есть много отличной информации о вирусах, включая новости, примечания к курсу и некоторые великолепные компьютерные изображения и анимации вирусов.

 Рассмотрим подробнее основные варианты размножения хосты.
Рассмотрим подробнее основные варианты размножения хосты. При этом глубина ямки должна составлять 25 см, а расстояние между лунками – 35 см.
При этом глубина ямки должна составлять 25 см, а расстояние между лунками – 35 см.


