- Оносма простейшая — Onosma simplicissima
- Краснокнижный вид | ООПТ России
- Заявка на патент США для противопротозойного агента Патентная заявка (заявка № 20080254136, выданная 16 октября 2008 г.)
- Стойкость токсической активности ферментационных экстрактов из Bacillus thuringiensis var. israelensis после более чем трех десятилетий хранения
Оносма простейшая — Onosma simplicissima
Автор:  Анастасия Смелова Дата:  16th Апрель, 2018. Рубрика: Бурачниковые
Семейство Бурачниковые – Boraginaceae
ОНОСМА ПРОСТЕЙШАЯ Onosma simplicissima АХАЛЬ ОНОСМА (ОНОСМА)
Статус. Категория I – вид, находящийся под угрозой исчезновения.
Занесен в Красные книги Республики Мордовия (категория 2), Нижегородской области (категория Б) [1,2].
Краткое описание. Многолетнее травянистое растение или полукустарничек, 15–40 см высотой, опушенное сероватыми щетинистыми волосками, с прямостоячими крепкими цветоносными стеблями, древеснеющими в основании, многочисленными бесплодными побегами. Листья очередные, линейные или ланцетно-линейные, 3–5 см длиной и до 5 мм шириной, с подвернутыми вниз краями и прижатым шелковистым опушением. Чашечка 6–8 мм, при плодах 13 мм длиной, прижато-серощетинистая. Цветки до 2 см длиной с трубчатоколокольчатым желтовато-белым венчиком, собраны в вильчатые соцветия, состоящие из двух завитков. Тычинки немного короче венчика [3, 4, 5].
Тычинки немного короче венчика [3, 4, 5].
Распространение. Восточноевропейско-североказахстанский вид, распространен в степной зоне европейской части России и южной Сибири. Произрастает во всех соседних регионах, за исключением Республики Марий Эл [4–6]. В Чувашии отмечен в Батыревском (окр. д. Малые Шихирданы, за пределами Батыревского участка ГПЗ «Присурский») и Яльчикском районах (окр. с. Эшмикеево – Яльчикский участок ГПЗ «Присурский») [9–14].
Особенности экологии и биологии. Хамефит. Светолюбивый степной вид, кальцефит. Олиготроф. Произрастает по каменистым разнотравно-ковыльным участкам степей с известковой подпочвой [3]. Цветет в мае–июле. Опыляется насекомыми. Плодоносит в июле–августе. Размножается семенами.
Численность и тенденции ее изменения. Численность снижается. Ранее вид указывался для юго-запада и юго-востока республики [7, 8]. В настоящее время известны 2 местонахождения вида на юго-востоке республики с единичными особями.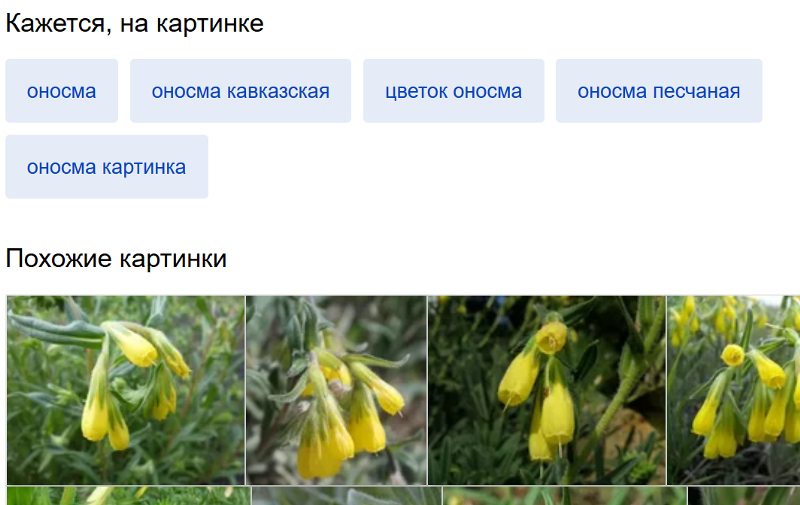 В одном из них – на Яльчикском участке ГПЗ «Присурский» при ежегодных исследованиях был найден лишь дважды – в 1995 и 2018 гг., где находится на грани исчезновения [9–15].
В одном из них – на Яльчикском участке ГПЗ «Присурский» при ежегодных исследованиях был найден лишь дважды – в 1995 и 2018 гг., где находится на грани исчезновения [9–15].
Лимитирующие факторы. Приуроченность к специфичным местообитаниям. Перевыпас скота, нарушение или зарастание местообитаний. Произрастание на северной границе ареала.
Принятые меры охраны. Охраняется на Яльчикском участке ГПЗ «Присурский» [9–11, 14].
Необходимые меры охраны. Выявление и охрана мест произрастания путем организации ООПТ. Расширение Батыревского участка ГПЗ «Присурский» [12, 13]. Контроль состояния популяций.
Источники информации. 1. Красная книга Нижегородской области, 2017; 2. Красная книга Республики Мордовия, 2017; 3. Конечная, 1994; 4. Губанов и др., 2004; 5. Маевский, 2014; 6. Абрамов, 2000; 7.Плетнева-Соколова, 1940; 8. Куданова, 1965; 9, 10,11, 12. Гафурова, 1997б, 2014а, 2017в, 2018в; 13.Рахматуллин, Димитриев, 2007; 14. Гербарный материал: ЧНМ; 15. Данные составителя.
Гербарный материал: ЧНМ; 15. Данные составителя.
Составитель: М.М. Гафурова.
Автор фото: М.М. Гафурова.
Красная книга Чувашской Республики. 2001 Класс Двудольные Magnoliopsida (= Dicotyledones) ОНОСМА ПРОСТЕЙШАЯ Onosmasimplicissima L. ОНОСМА Статус. II категория. Уязвимый вид.
Порядок Бурачникоцветные Boraginales
Семейство Бурачниковые Boraginaceae
Описание. Полукустарничек, 15-40 см высотой. Листья линейно-ланцетные, острые, сероватые от густого опушения. Венчик желтовато-белый, кверху расширенный, в 3 раза длиннее чашечки. Цветет в мае — сентябре.
Распространение. Восточная Европа, Западная и Восточная Сибирь, Средняя Азия Произрастает в черноземной полосе, севернее очень редко. Считается редким видом в Республике Татарстан, на Урале, Приуралье. В Чувашской Республике встречается в юго- восточной части по остепненным склонам.
Места обитания. Каменистые участки степей, известковые и меловые выходы.
Лимитирующие факторы. Сокращение местообитаний, чрезмерный выпас скота.
Меры охраны. Охрана местообитаний. Охраняется в Яльчикском участке государственного природного .заповедника «Присурский».
Источники информации: Куданова, 1965; Красная книга…, 1995; Гафурова, 1997 б, 1998 а,
1997 а.
Составитель: М.М.Гафурова.
Фотогалерея:
Краснокнижный вид | ООПТ России
Главная
Краснокнижный вид
Классификация: Основные группы > Vascular plants (Сосудистые растения) > Magnoliophyta (Покрытосеменные) > Eudicots (Настоящие двудольные) > unplaced in an order (не включены в какой-либо порядок) > Boraginaceae (Бурачниковые) > Onosma (Оносма)
| Таксон | Onosma simplicissima (Оносма простейшая) |
| Русское название | Оносма простейшая |
Правовой статус
| Документ | Приложение | Дата | Номер таксона | Указан как | Статус | Категория | Дополнительно |
|---|---|---|---|---|---|---|---|
| 2006-04-07 | 24 | добавлен | 1 |
Описания
| Издание |
Киселёва ЛЛ, Вышегородских НВ, Пригоряну ОМ, Вышегородских НВ, Арабаджи АА, Вышегородских ЕВ (2007) Красная книга Орловской области. Грибы. Растения. Животные. Орел: Центр Ковыль 1 264 PDF Грибы. Растения. Животные. Орел: Центр Ковыль 1 264 PDF |
| Таксон указан как | Onosma simplicissima |
| Категория | 1: Находящийся под угрозой исчезновения вид |
| Морфологическое описание |
Невысокий полукустарничек (15–40 см высотой), опушенный сероватыми щетинистыми волосками. Цветоносные побеги простые, прямостоячие, одревеснеющие в основании. Бесплодные побеги многочисленные. Листья очередные, ланцетно-линейные, длиной 3–5 см и шириной до 5 мм, со слегка завернутыми краями, сероватые от прижатых щетинок, сидящих на бугорках.Довольно крупные, длиной около 2 см, цветки собраны в короткий простой или раздвоенный завиток. Чашечка глубоко-пятираздельная, с узколинейными долями. Венчик желтовато-белый, около 17 мм длиной (в 3 раза длиннее чашечки), правильный, трубчато-булавовидный, с 5 короткими зубцами. Тычинок 5, они прикреплены к трубке венчика и чередуются с его лопастями. Пестик 1, образован двумя плодолистиками, которые на ранних этапах развития разделяются продольно перегородкой, вследствие чего завязь оказывается четырехгнездной. Каждое гнездо содержит один семязачаток. Завязь верхняя, при основании окружена кольцевым диском, выделяющим нектар. Плод сухой, распадающийся на 4 орешка (темно-серые, яйцевидно-треугольные, с килем, острые, гладкие). Цветоножки при плодах до 10 мм длиной. Семена выбрасываются при сильном раскачивании ветром цветоножек. Тычинок 5, они прикреплены к трубке венчика и чередуются с его лопастями. Пестик 1, образован двумя плодолистиками, которые на ранних этапах развития разделяются продольно перегородкой, вследствие чего завязь оказывается четырехгнездной. Каждое гнездо содержит один семязачаток. Завязь верхняя, при основании окружена кольцевым диском, выделяющим нектар. Плод сухой, распадающийся на 4 орешка (темно-серые, яйцевидно-треугольные, с килем, острые, гладкие). Цветоножки при плодах до 10 мм длиной. Семена выбрасываются при сильном раскачивании ветром цветоножек. |
| Распространение |
В Орловской области крайне редкое растение. Находится на северо-западной границе ареала. Встречается только в Ливенском районе, в урочище Кузилинка близ с. Навесного (каменистая степь и обнажения известняка на крутом левом берегу реки Олым) (Радыгина, Киселева, Пригоряну, 1996; Еленевский, Радыгина, 2005). Ареал вида охватывает лесостепные и степные регионы Восточной Европы, юга западной Сибири и Средней Азии. В России оносма простейшая распространена в европейской части и на юге Сибири. В России оносма простейшая распространена в европейской части и на юге Сибири. |
| Образ жизни | Растет по каменистым степям и обнажениям известняка. Ярко выраженный кальцефит; светолюбивое растение, не встречается среди кустарников и под пологом леса. Цветет в мае-августе, плоды созревают в июне-октябре. |
| Лимитирующие факторы | Распашка степей и разработка известняка, выпас скота, зарастание известняковых обнажений, и формирование на их месте степных сообществ и зарослей кустарников; усиленная рекреационная нагрузка, сборы растений в букеты. |
| Охранные меры |
Вид внесен в список охраняемых растений области с 1991 г. Охраняется на территории памятника природы «Урочище Кузилинка» в Ливенском районе. Необходимы: строгое соблюдение режима охраны на ООПТ, контроль состояния популяции, выявление новых мест произрастания, запрещение сбора растений. |
| Составители | Л.Л. Киселёва, О.М. Пригоряну |
Заявка на патент США для противопротозойного агента Патентная заявка (заявка № 20080254136, выданная 16 октября 2008 г.)
ОБЛАСТЬ ТЕХНИКИНастоящее изобретение относится к противопротозойному агенту.
УРОВЕНЬ ТЕХНИКИ С точки зрения применения химиотерапии против инфекционных заболеваний, вызываемых простейшими, приобретение лекарственной устойчивости такими простейшими рассматривается как наиболее серьезная проблема. Например, типичным примером такой проблемы является лекарственная устойчивость малярии falciparum. К настоящему времени были разработаны некоторые терапевтические агенты. Однако были обнаружены простейшие, приобретшие устойчивость к таким агентам. Таким образом, протозойные инфекционные заболевания получили широкое распространение в мире. Одним из таких протозойных инфекционных заболеваний является лейшманиоз.
Одним из таких протозойных инфекционных заболеваний является лейшманиоз.
Лейшманиоз представляет собой паразитарное заболевание, вызываемое простейшими leishmania и эндемичное для тропических регионов, включая Южную Америку. Болезнь является одной из шести тропических болезней, выявленных ВОЗ. Всего насчитывается около 12 000 000 пациентов в Африке, на Ближнем Востоке, в Центральной и Южной Америке и Азии. Кроме того, ежегодно этим заболеванием заражаются 400 000 человек. В пути передачи участвует москит-флеботомин, являющийся гематофагом. Инфекция устанавливается, когда простейшие лейшмании проникают в москита-флеботомина через укусы, сделанные, когда москит сосет кровь. Простейшие паразитируют на макрофагах, что приводит к развитию патологических состояний висцерального, кожного и слизисто-кожного лейшманиоза. Патологические состояния при висцеральном лейшманиозе особо опасны, в тяжелых случаях приводят к летальному исходу.
Leishmania простейшие сгруппированы в следующие четыре категории (комплексы): Leishmania donovani; Л. тропика; Л. Мексикана; и L. braziliensis. Каждый комплекс вызывает разные патологические состояния. В основном такие состояния возникают в результате паразитирования простейших в том или ином органе и в местных макрофагах. Висцеральный лейшманиоз вызывается паразитированием L. donovani в макрофагах и клетках ретикулоэндотелиальной системы печени, селезенки, костного мозга и т.п. Его основные симптомы включают отек печени и селезенки, анемию, лейкоцитопению, лихорадку и лимфаденопатию. Кожный лейшманиоз подразделяется на следующие две категории: лейшманиоз Старого Света и лейшманиоз Нового Света. Кожный лейшманиоз Старого Света вызывают L. tropica , а кожный лейшманиоз нового мира вызывается L. Mexicana. Простейшие каждого комплекса паразитируют на кожных макрофагах, образуя кожные язвы. L. braziliensis вызывает кожно-слизистый лейшманиоз, при котором образуются кожно-слизистые и кожные поражения. Однако иногда он вызывает кожный лейшманиоз.
тропика; Л. Мексикана; и L. braziliensis. Каждый комплекс вызывает разные патологические состояния. В основном такие состояния возникают в результате паразитирования простейших в том или ином органе и в местных макрофагах. Висцеральный лейшманиоз вызывается паразитированием L. donovani в макрофагах и клетках ретикулоэндотелиальной системы печени, селезенки, костного мозга и т.п. Его основные симптомы включают отек печени и селезенки, анемию, лейкоцитопению, лихорадку и лимфаденопатию. Кожный лейшманиоз подразделяется на следующие две категории: лейшманиоз Старого Света и лейшманиоз Нового Света. Кожный лейшманиоз Старого Света вызывают L. tropica , а кожный лейшманиоз нового мира вызывается L. Mexicana. Простейшие каждого комплекса паразитируют на кожных макрофагах, образуя кожные язвы. L. braziliensis вызывает кожно-слизистый лейшманиоз, при котором образуются кожно-слизистые и кожные поражения. Однако иногда он вызывает кожный лейшманиоз.
Как описано выше, простейшие лейшмании очень разнообразны. Также с точки зрения иммунологии существуют региональные различия в антигенности даже при сходных патологических состояниях. Это вызывает трудности в разработке вакцин. Таким образом, существует существенная потребность в химиотерапии.
Недавно пятивалентная сурьма (торговые названия: Pentostam и Glucantime) использовалась в качестве препарата первой линии для лечения лейшманиоза. В случае, когда такое средство неэффективно, применяют пентамидин, амфотерицин В и т.п. Однако эти препараты могут вызывать сильные побочные реакции. Таким образом, врачи должны быть осторожны при их использовании. Кроме того, проблематична также высокая стоимость сурьмы.
В дополнение к вышеизложенному, Патентный документ 1 раскрывает в качестве терапевтических средств сесквитерпеноидное соединение типа гермакранолида или типа гваянолида и лекарственное средство, содержащее его. Патентный документ 2 раскрывает производное триазола, эффективное для лечения лейшманиоза.
Однако ожидается разработка недорогого терапевтического средства с небольшим количеством побочных реакций.
Между тем, «Сиунко» — это китайская лечебная мазь, которую разработал хирург Сейшу Ханаока в эпоху Эдо. Известно, что мазь обладает противовоспалительным, болеутоляющим, кровоостанавливающим, антисептическим, омолаживающим и другими эффектами. Он эффективен при хирургических заболеваниях, таких как ожоги, порезы, царапины, геморрой (с болью, анальными трещинами, кровотечением и анальным выпадением, вызванным геморроем), пролежни (пролежни), панариций и тому подобное. Примеры кожных заболеваний, при которых эффективна мазь, включают экзему, экзему домохозяек, атопический дерматит, псориаз, кератодермию, потрескавшуюся кожу и ксероз (на губах, кистях рук, стопах, пятках и локтях), эпидермофитию стоп, мозоли, мозоли, бородавки. , потница, раздражение кожи, прыщи, пятна, гнойные пустулы, фурункулы, пигментные пятна, волдыри, обморожение, эрозии, язвы и укусы насекомых. В частности, было показано, что мазь эффективна при ожогах, поскольку применение мази предотвращает образование волдырей. Однако до сих пор не было сообщений о применении Шиунко при кожных заболеваниях, отнесенных к тропическим инфекционным заболеваниям.
В частности, было показано, что мазь эффективна при ожогах, поскольку применение мази предотвращает образование волдырей. Однако до сих пор не было сообщений о применении Шиунко при кожных заболеваниях, отнесенных к тропическим инфекционным заболеваниям.
Шиунко состоит из Lithospermi Radix (шикон), Angelicae Radix (токи), кунжутного масла, сала и пчелиного воска. Lithospermi Radix является корнем Lithospermum erythrorhizon Sieb. Et Zucc ( Lithospermum erythrorhizon ) или Lithospermum euchroma Royle ( Macrotomia euchroma ( Royle ) Pauls ), каждый из это растение, принадлежащее к семейству Boraginaceae. Продукт, полученный из первого, называется «ко-шикон». Продукт, полученный из последнего, называется «нан-шикон». Сообщалось, что его компонентами являются нафтохиноновые красители, такие как шиконин, β,β-диметилакрилшиконин, ацетилшиконин, изобутирилшиконин, изовалерилшиконин, теракрилшиконин, дезоксишиконин и ангидроалканин. Angelicae Radix : Angelica acutiloba Kitagawa (ohbuka-tohki) или Angelica acutiloba Kitagawa var. сугиямаэ Хикино (хоккай-токи). Сообщалось, что его компонентами являются бутилиденфталид, сафрол, седаноновая кислота, валерофенон-о-карбоновая кислота, фалкариндиол, фалкаринол, фалькаринолон и т.п.
Angelicae Radix : Angelica acutiloba Kitagawa (ohbuka-tohki) или Angelica acutiloba Kitagawa var. сугиямаэ Хикино (хоккай-токи). Сообщалось, что его компонентами являются бутилиденфталид, сафрол, седаноновая кислота, валерофенон-о-карбоновая кислота, фалкариндиол, фалкаринол, фалькаринолон и т.п.
[Патентный документ 1] Публикация патента Японии (Kokai) № 2001-226369 A
[Патентный документ 2] Публикация патента Японии (Kokai) № 2003-146877 A
РАСКРЫТИЕ ИЗОБРЕТЕНИЯЦелью настоящего изобретения является создание недорогого противопротозойного средства с небольшим количеством побочных лекарственных реакций, которое особенно эффективно в качестве противолейшманиозного средства.
Настоящее изобретение охватывает следующие изобретения.
- (1) Противопротозойное средство, содержащее в качестве активного ингредиента соединение формулы (I):
где R представляет собой -H или ацил,
- их соль или сольват любого из них.

- (2) Противопротозойный агент, описанный в (1), где соединение формулы (I) представляет собой соединение формулы (II):
, где R 1 представляет собой -H, -C(=O)CH 3 , -C(=O)CH(CH 3 ) 2 , -C(=O)CH 2 C(CH 3 ) 2 OH, -C( =О)СН 2 CH(CH 3 ) 2 , -C(=O)CH(CH 3 )CH 2 CH 3 или -C(=O)CH=C(CH 3 ) 2 или
- соединение формулы (III):
- (3) Противопротозойное средство, содержащее в качестве активного ингредиента вещество, полученное из Lithospermi Radix 9001 8 и обладающий антипротозойной активностью .
- (4) Противопротозойное средство, содержащее в качестве активного ингредиента экстракт из Lithospermi Radix или его обработанный продукт.
- (5) Противопротозойное средство, описанное в (3) или (4), содержащее в качестве активного ингредиента экстракт из Angelicae Radix или продукт его обработки.

- (6) Противопротозойное средство, содержащее в качестве активного ингредиента Шиунко.
- (7) Противопротозойный агент, описанный в любом из пп. 1-6, где агент представляет собой противолейшманиозный агент.
- (8) Противопротозойное средство по п. 7 для применения при лечении лейшманиоза.
В соответствии с настоящим изобретением предлагается противопротозойный агент. Противопротозойный агент по настоящему изобретению особенно эффективен для лечения лейшманиоза.
Противопротозойный агент по настоящему изобретению содержит в качестве активного ингредиента вещество природного происхождения. Таким образом, такой агент имеет мало проблем с точки зрения неблагоприятных лекарственных реакций.
Это описание включает часть или все содержание, раскрытое в описании заявки на патент Японии № 2004-223485, которая является приоритетным документом настоящей заявки.
Авторы настоящего изобретения обнаружили, что сильное противопротозойное действие придается соединению формулы (I):
, где R представляет собой -H или ацил. Соединение формулы (I) имеет асимметричные атомы углерода. Однако соединение может быть в форме оптически активного вещества или рацемата. Также соединение формулы (I) может быть в форме соли. Кроме того, соединение формулы (I) или его соль могут быть в форме сольвата. Когда вышеупомянутую соль или сольват используют в качестве противопротозойного агента, они должны быть фармацевтически приемлемыми.
Когда R в формуле (I) представляет собой ацил, R может быть алифатическим или ароматическим ацилом. Обычно такой ацил имеет от 2 до 24 атомов углерода.
Типичным примером алифатического ацила является линейный или разветвленный алкил, содержащий от 1 до 23, предпочтительно от 1 до 10, более предпочтительно от 1 до 8, еще более предпочтительно от 1 до 6 и наиболее предпочтительно от 1 до 4 атомов углерода; линейный или разветвленный алкенил, содержащий от 2 до 23, предпочтительно от 2 до 10, более предпочтительно от 2 до 8, еще более предпочтительно от 2 до 6 и наиболее предпочтительно от 2 до 4 атомов углерода; или линейный или разветвленный алкинил, содержащий от 2 до 23, предпочтительно от 2 до 10, более предпочтительно от 2 до 8, еще более предпочтительно от 2 до 6 и наиболее предпочтительно от 2 до 4 атомов углерода; к концу которого присоединен карбонил. Описанный выше алифатический ацил может быть замещен соответствующим заместителем, таким как гидрокси, алкокси, содержащий от 1 до 6 атомов углерода, тиол или алкилтио, содержащий от 1 до 6 атомов углерода. Особенно предпочтительными примерами алифатического ацила являются -C(=O)CH 3 , -C(=O)CH(CH 3 ) 2 , -C(=O)CH 2 C(CH 3 ) 2 OH, -C( =О)СН 2 CH(CH 3 ) 2 , -C(=O)CH(CH 3 )CH 2 CH 3 , и -C(=O)CH=C (СН 3 ) 2 .
Описанный выше алифатический ацил может быть замещен соответствующим заместителем, таким как гидрокси, алкокси, содержащий от 1 до 6 атомов углерода, тиол или алкилтио, содержащий от 1 до 6 атомов углерода. Особенно предпочтительными примерами алифатического ацила являются -C(=O)CH 3 , -C(=O)CH(CH 3 ) 2 , -C(=O)CH 2 C(CH 3 ) 2 OH, -C( =О)СН 2 CH(CH 3 ) 2 , -C(=O)CH(CH 3 )CH 2 CH 3 , и -C(=O)CH=C (СН 3 ) 2 .
Типичным примером ароматического ацила является арил, содержащий от 5 до 12 атомов углерода, который может быть замещен соответствующим заместителем, таким как гидрокси, алкокси, содержащий от 1 до 6 атомов углерода, тиол или алкилтио, содержащий от 1 до 6 атомов углерода. атомов, и к концу которого присоединен карбонил или группа, образованная удалением одного атома водорода из описанного выше алифатического ацила. Его примеры включают бензоил, 1-нафтилкарбонил и 2-нафтилкарбонил.
Его примеры включают бензоил, 1-нафтилкарбонил и 2-нафтилкарбонил.
Среди соединений, описанных выше, особенно предпочтительным соединением является следующее известное соединение; то есть соединение формулы (II):
, где R 1 представляет собой -H (шиконин), -C(=O)CH 3 (ацетилшиконин), -C(=O)CH(CH 3 ) 2 (изобутирилшиконин), -C(=O)CH 2 C(CH 3 ) 2 OH (β-гидроксиизовалерилшиконин), -C(=O)CH 900 97 2 СН( CH 3 ) 2 (изовалерилшиконин), -C(=O)CH(CH 3 )CH 2 CH 3 (α-метил-н-бутирилшиконин) или -C(=O)CH=C(CH 3 ) 2 (β,β-диметилакрилшиконин)), или соединение формулы (III):
(алканин).
Также предпочтительно можно использовать смесь двух или более таких соединений.
Эти известные соединения могут быть синтезированы химически или выделены из природного продукта. Кроме того, можно использовать коммерчески доступные продукты. Например, 7 типов соединений на основе формулы (II) могут быть выделены из Lithospermi Radix для использования. Соединение формулы (III) может быть выделено из Alkanna tinctoria, Onosma echoides, Lithospermum arvense, или т.п. для использования. Кроме того, соединение формулы (I) может быть получено из природного продукта. Например, такое соединение может быть получено из шиконина в соответствии со способами, описанными в Bioorganic & Medicinal Chemistry Letters, 12 (10), 1375-1378, 2002, и в публикации патента Японии (Kokai) № 61-151151 A 19.86 (дата публикации: 9 июля 1986 г.).
Кроме того, можно использовать коммерчески доступные продукты. Например, 7 типов соединений на основе формулы (II) могут быть выделены из Lithospermi Radix для использования. Соединение формулы (III) может быть выделено из Alkanna tinctoria, Onosma echoides, Lithospermum arvense, или т.п. для использования. Кроме того, соединение формулы (I) может быть получено из природного продукта. Например, такое соединение может быть получено из шиконина в соответствии со способами, описанными в Bioorganic & Medicinal Chemistry Letters, 12 (10), 1375-1378, 2002, и в публикации патента Японии (Kokai) № 61-151151 A 19.86 (дата публикации: 9 июля 1986 г.).
Настоящее изобретение также относится к противопротозойному средству, содержащему в качестве активного ингредиента вещество, полученное из Lithospermi Radix и обладающее противопротозойной активностью. Кроме того, противопротозойный агент по настоящему изобретению предпочтительно содержит в качестве активного ингредиента экстракт из Angelicae Radix или его обработанный продукт.
Lithospermi Radix или Angelicae Radix , используемая в настоящем изобретении, конкретно не ограничена с точки зрения зоны производства или сорта породы. Lithospermi Radix или Angelicae Radix можно использовать после того, как они подверглись порошковой обработке путем разрушения, измельчения и т.п. Его предпочтительно используют в форме экстракта или обработанного продукта.
В качестве растворителя для экстракции предпочтителен гексан. Однако также можно использовать метанол, этанол, бутанол, изопропанол, этиловый эфир уксусной кислоты, ацетон, бензол, циклогексан, хлороформ, дихлорметан и т.п. Как правило, на 1 кг Lithospermi Radix или Angelicae Radix.
Особых ограничений по температуре экстракции нет. Температура экстракции может находиться между точкой плавления и точкой кипения растворителя. Можно также проводить сверхкритическую экстракцию. Кроме того, экстракцию обычно проводят при атмосферном давлении; однако его можно проводить при повышении или понижении давления. Время экстракции различается в зависимости от температуры экстракции и т.п. Как правило, это от 6 до 24 часов.
Время экстракции различается в зависимости от температуры экстракции и т.п. Как правило, это от 6 до 24 часов.
Экстракт, полученный, как описано выше, фильтруют с использованием ткани, фильтра из нержавеющей стали, фильтровальной бумаги и т.п., чтобы удалить из него примеси и т.п. Таким образом, можно получить интересующий экстракт. Кроме того, экстракт может быть подвергнут такой обработке, как сушка распылением, сушка вымораживанием и сверхкритическая обработка после фильтрации.
Экстракт, полученный, как описано выше, можно непосредственно использовать в качестве активного ингредиента противопротозойного средства по настоящему изобретению. Кроме того, такой экстракт можно использовать в качестве обработанного продукта с улучшенной активностью путем его обработки с использованием различных средств очистки, таких как ионообменная хроматография, гель-фильтрационная хроматография и диализ.
Кроме того, противопротозойный агент по настоящему изобретению может быть составлен путем объединения вышеупомянутого соединения, его соли, сольвата любого из них, экстракта или обработанного продукта Lithospermi Radix или Angelicae Radix с известный носитель лекарственного средства. Форма введения конкретно не ограничена, и, таким образом, она может быть адекватно выбрана в соответствии с необходимостью. Как правило, противопротозойный агент используют в виде пероральных средств, таких как таблетки, капсулы, гранулы, мелкие гранулы, порошки, жидкости, сиропы, суспензии, эмульсии и эликсиры. Альтернативно, он используется в формах парентеральных агентов, таких как парентеральные инъекции, инфузии, суппозитории, ингалянты, трансдермальные терапевтические системы, чресслизистые терапевтические системы, адгезивные препараты и мази.
Форма введения конкретно не ограничена, и, таким образом, она может быть адекватно выбрана в соответствии с необходимостью. Как правило, противопротозойный агент используют в виде пероральных средств, таких как таблетки, капсулы, гранулы, мелкие гранулы, порошки, жидкости, сиропы, суспензии, эмульсии и эликсиры. Альтернативно, он используется в формах парентеральных агентов, таких как парентеральные инъекции, инфузии, суппозитории, ингалянты, трансдермальные терапевтические системы, чресслизистые терапевтические системы, адгезивные препараты и мази.
Доза противопротозойного агента по настоящему изобретению различается в зависимости от возраста и веса пациента, тяжести заболевания и пути введения. В случае перорального введения его доза составляет от 10 до 3000 мг в день, например, высушенного порошка гексанового экстракта из Lithospermi Radix. Кроме того, в случае перорального введения дозы обычно вводят от 1 до 3 раз в день.
Пероральное средство по настоящему изобретению производится с использованием наполнителей, таких как крахмал, лактоза, сахароза, маннит, карбоксиметилцеллюлоза, кукурузный крахмал и неорганические соли, в соответствии с общепринятым методом.
Для состава этого типа, в дополнение к вышеупомянутым эксципиентам, могут быть надлежащим образом использованы связующие, разрыхлители, поверхностно-активные вещества, смазывающие вещества, агенты, способствующие текучести, ароматизаторы, красители, отдушки и т.п.
Конкретные примеры связующих включают кристаллическую целлюлозу, кристаллическую целлюлозу кармеллоза натрия, метилцеллюлозу, гидроксипропилцеллюлозу, низкозамещенную гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксипропилметилцеллюлозы, кармеллозу натрия, этилцеллюлозу, карбоксиметилэтилцеллюлозу, гидроксиэтилцеллюлозу, пшеничный крахмал, рисовый крахмал, кукурузный крахмал, картофель крахмал, декстрин, прежелатинизированный крахмал, частично прежелатинизированный крахмал, гидроксипропилкрахмал, пуллулан, поливинилпирролидон, сополимер аминоалкилметакрилата E, сополимер аминоалкилметакрилата RS, сополимер метакрилата L, сополимер метакрилата, поливинилацеталь диэтиламиноацетат, поливиниловый спирт, гуммиарабик, порошок гуммиарабика, агар, желатин, белый шеллак, трагант, рафинированный белый сахар и макрогол.
Конкретные примеры разрыхлителей включают кристаллическую целлюлозу, метилцеллюлозу, низкозамещенную гидроксипропилцеллюлозу, кармеллозу, кармеллозу кальция, кармеллозу натрия, кроскармеллозу натрия, пшеничный крахмал, рисовый крахмал, кукурузный крахмал, картофельный крахмал, частично прежелатинизированный крахмал, гидроксипропилкрахмал, карбоксиметил натрия крахмал и трагант.
Примеры поверхностно-активных веществ включают соевый лецитин, жирный эфир сахарозы, полиоксилстеарат, полиоксиэтиленгидрогенизированное касторовое масло, полиоксиэтиленполиоксипропиленгликоль, сорбитансесквиолеат, сорбитантриолеат, сорбитанмоностеарат, сорбитанмонопальмитат, сорбитанмонолаурат, полисорбат, глицерилмоностеарат, натрий лаурилсульфат и лауромакрогол.
Примеры смазывающих веществ включают пшеничный крахмал, рисовый крахмал, кукурузный крахмал, стеариновую кислоту, стеарат кальция, стеарат магния, водный диоксид кремния, легкий кремниевый ангидрид, синтетический силикат алюминия, высушенный гель гидроксида алюминия, тальк, метасиликат алюминат магния, гидрофосфат кальция. , безводный двухосновный фосфат кальция, жирный эфир сахарозы, воски, гидрогенизированное растительное масло и полиэтиленгликоль.
, безводный двухосновный фосфат кальция, жирный эфир сахарозы, воски, гидрогенизированное растительное масло и полиэтиленгликоль.
Конкретные примеры агентов, повышающих текучесть, включают водный диоксид кремния, легкий кремниевый ангидрид, сухой гель гидроксида алюминия, синтетический силикат алюминия и силикат магния.
Кроме того, противопротозойный агент, используемый в настоящем изобретении, может включать ароматизаторы и красители при введении в виде жидкостей, сиропов, суспензий, эмульсий и эликсиров.
Противопротозойный агент по настоящему изобретению можно использовать в виде так называемых пищевых продуктов для определенных медицинских целей (например, пищевых продуктов против лейшманиоза) и т.п. при добавлении к пищевым продуктам, жевательной резинке, напиткам и т.п.
Шиунко, существующее китайское лекарство, содержащее ингредиент, полученный из Lithospermi Radix и Angelicae Radix, также предпочтительны в качестве противопротозойного агента по настоящему изобретению. Поскольку Шиунко известна как мазь, которая значительно эффективна при повреждениях кожи, ее можно применять в случае лейшманиоза, особенно в таких случаях, как кожный лейшманиоз или кожно-слизистый лейшманиоз. Примеры Shiunko, которые можно использовать, включают коммерчески доступные продукты, поставляемые Tsumura & Co., Maruishi Pharmaceutical Co., Ltd., Kanebo Pharmaceutical Co., Ltd. и Matsuura Kanpo Co., Ltd. Кроме того, Shiunko можно производить в в соответствии с известным способом, как описано ниже. Сначала нагревают кунжутное масло. В него добавляют пчелиный воск, чтобы он расплавился в нем. Затем туда добавляют сало, чтобы все ингредиенты полностью расплавились в нем. 9К ним добавляют 0017 Angelicae Radix . После того, как цвет поверхности Angelicae Radix станет горелым и будет достигнута достаточная экстракция, Angelicae Radix удаляют с нее и добавляют Lithospermi Radix . После достижения достаточной экстракции оттуда удаляют Lithospermi Radix .
Поскольку Шиунко известна как мазь, которая значительно эффективна при повреждениях кожи, ее можно применять в случае лейшманиоза, особенно в таких случаях, как кожный лейшманиоз или кожно-слизистый лейшманиоз. Примеры Shiunko, которые можно использовать, включают коммерчески доступные продукты, поставляемые Tsumura & Co., Maruishi Pharmaceutical Co., Ltd., Kanebo Pharmaceutical Co., Ltd. и Matsuura Kanpo Co., Ltd. Кроме того, Shiunko можно производить в в соответствии с известным способом, как описано ниже. Сначала нагревают кунжутное масло. В него добавляют пчелиный воск, чтобы он расплавился в нем. Затем туда добавляют сало, чтобы все ингредиенты полностью расплавились в нем. 9К ним добавляют 0017 Angelicae Radix . После того, как цвет поверхности Angelicae Radix станет горелым и будет достигнута достаточная экстракция, Angelicae Radix удаляют с нее и добавляют Lithospermi Radix . После достижения достаточной экстракции оттуда удаляют Lithospermi Radix . Полученный продукт фильтруют, чтобы удалить любой оставшийся остаток. Полученному продукту дают отстояться, чтобы он затвердел. Твердый продукт в достаточной степени разминается с помощью пластинки мази, чтобы затем его можно было использовать.
Полученный продукт фильтруют, чтобы удалить любой оставшийся остаток. Полученному продукту дают отстояться, чтобы он затвердел. Твердый продукт в достаточной степени разминается с помощью пластинки мази, чтобы затем его можно было использовать.
Далее настоящее изобретение описано более подробно со ссылкой на следующие примеры, хотя технический объем настоящего изобретения ими не ограничивается. Пример 1 18 и Angelicae Radix (получен метод, использованный для справочного примера 2), шиконин (Nagara Science), ацетилшиконин (Nagara Science), β,β-диметилакрилшиконин (Nagara Science), изобутирилшиконин (Nagara Science), α-метил-н-бутирилшиконин (Nagara Science), изовалерилшиконин (Nagara Science), β-гидроксиизовалерилшиконин (Nagara Science) и алканин (Wako Pure Chemical Industries, Ltd.) подвергали измерению антилейшманиозной активности.
Сначала от 1 до 5 мг каждого образца растворяли в диметилсульфоксиде (ДМСО) таким образом, чтобы приготовить растворы ДМСО (10 мг/мл). Затем растворы разбавляли средой 199 (800 мкг/мл) и пропускали через мембранный фильтр. Полученные испытуемые растворы доводили до 9 различных концентраций. Исследуемые растворы (50 мкл) в различных концентрациях и культуральный раствор лейшманий (50 мкл), доведенный до конечной концентрации 2×10 5 /мл, вносили в лунки титрационного микропланшета таким образом, чтобы общий объем каждый культуральный раствор составлял 100 мкл в каждой лунке. После инкубации при 27°С в присутствии 5% СО 2 на 48 часов, туда добавляли 10 мкл реагента Tetracolor ONE с последующей инкубацией в течение 6 часов. После этого измеряли значение оптической плотности (450-630 нм) с помощью устройства для считывания микропланшетов. Каждый образец при каждой концентрации (3 лунки) подвергали измерению таким образом, чтобы получить среднее значение. Затем был создан график, на котором было получено значение IC 50 . В таблице 1 показаны результаты.
Затем растворы разбавляли средой 199 (800 мкг/мл) и пропускали через мембранный фильтр. Полученные испытуемые растворы доводили до 9 различных концентраций. Исследуемые растворы (50 мкл) в различных концентрациях и культуральный раствор лейшманий (50 мкл), доведенный до конечной концентрации 2×10 5 /мл, вносили в лунки титрационного микропланшета таким образом, чтобы общий объем каждый культуральный раствор составлял 100 мкл в каждой лунке. После инкубации при 27°С в присутствии 5% СО 2 на 48 часов, туда добавляли 10 мкл реагента Tetracolor ONE с последующей инкубацией в течение 6 часов. После этого измеряли значение оптической плотности (450-630 нм) с помощью устройства для считывания микропланшетов. Каждый образец при каждой концентрации (3 лунки) подвергали измерению таким образом, чтобы получить среднее значение. Затем был создан график, на котором было получено значение IC 50 . В таблице 1 показаны результаты.
Как видно из таблицы 1, гексановый экстракт из Lithospermi Radix, гексановый экстракт из смеси Lithospermi Radix и 9Было показано, что 0017 Angelicae и родственные шиконину соединения обладают сильной антилейшманиозной активностью. Справочный пример 1 колба. К смеси добавляли гексан в объеме, в 30 раз превышающем объем измельченного Lithospermi Radix , с последующей экстракцией при 45°С в течение 5 часов. Затем проводили фильтрацию. Полученный фильтрат подвергали концентрированию и обезвоживанию с получением его экстракта.
Справочный пример 1 колба. К смеси добавляли гексан в объеме, в 30 раз превышающем объем измельченного Lithospermi Radix , с последующей экстракцией при 45°С в течение 5 часов. Затем проводили фильтрацию. Полученный фильтрат подвергали концентрированию и обезвоживанию с получением его экстракта.
Получение гексанового экстракта из смеси Lithospermi Radix и Angelicae Radix
Эквивалентное количество высушенного Lithospermi Radix и высушенный Angelicae Radix , который был тонко измельчен с помощью мельницы взвешивали и помещали в колбу баклажанного типа. К смеси добавляли гексан в объеме, в 30 раз превышающем объем смеси Lithospermi Radix и Angelicae Radix , с последующей экстракцией при 45°С в течение 5 часов. Затем проводили фильтрацию. Полученный фильтрат подвергали концентрированию и обезвоживанию с получением его экстракта.
Пример 2 Шиунко вводили пациентам, пораженным кожным лейшманиозом, так что лечебные эффекты Шиунко были подтверждены in vivo.
Используемый Shiunko был Shiunko производства Matsuura Kanpo Co., Ltd. Состав этого Shiunko (1 г) был получен путем смешивания в качестве исходных материалов 0,08 г Angelicae Radix, 0,30 г пчелиного воска, 0,12 г Lithospermi Radix, 0,03 г свиного сала и 1,0 г кунжутного масла, переводя действующие вещества лекарственного сырья ( Angelicae Radix и Lithospermi Radix ) в масляную фазу (т.е. проведение экстракции) и удаление остатков неочищенных препаратов (остатки экстракции).
Подопытными были 26 больных кожным лейшманиозом. Ниже представлена разбивка пациентов по возрасту и полу.
Вышеуказанные 26 испытуемых были проинструктированы применять достаточное количество Шиунко два раза в день в течение 4 недель. Кроме того, их осматривал врач, отвечающий за клиническое исследование, один раз в неделю.
Кроме того, их осматривал врач, отвечающий за клиническое исследование, один раз в неделю.
Клинические наблюдения относительно внешнего вида с точки зрения размеров поражений (мм), состояния поражений (сухие или влажные) и т.п. проводились до, во время и после лечения. Ответы на лечение оценивались на основе четырехэтапной классификации.
Получены окончательные результаты контрольного обследования 14 из 26 испытуемых (53,84%). В таблице 3 показаны результаты. Было подтверждено, что Шиунко эффективен для лечения кожного лейшманиоза.
Все публикации, патенты и заявки на патенты, цитируемые здесь, полностью включены сюда посредством ссылки.
Стойкость токсической активности ферментационных экстрактов из Bacillus thuringiensis var. israelensis после более чем трех десятилетий хранения
На этой странице
РезюмеВведениеМатериалы и методыРезультатыОбсуждениеВыводыКонфликты интересовСсылкиАвторское правоСтатьи по теме Это исследование было проведено для определения стойкости токсичности экстрактов ферментации Bacillus thuringiensis вар. israelensis после более чем трех десятилетий хранения. С этой целью была создана популяция из Aedes aegypti . Смертность 20 экстрактов кристаллов спор, очищенных методом соосаждения ацетон-лактоза, измеряли и оценивали с помощью биоанализа в соответствии с модифицированным протоколом ВОЗ. Экстракты с самым высоким уровнем смертности определяли в трех повторностях по их LD 50 и LD 98 . Все экстракты показали токсичность при самой высокой испытанной дозе (1000 млн), а некоторые, такие как штаммы 3260 и 3501, по-прежнему убивали личинок даже при таких низких дозах, как 0,01 млн. Эти данные удивительны, потому что ни одно исследование активности B. thuringiensis токсичных белков после такого длительного хранения.
Эти данные удивительны, потому что ни одно исследование активности B. thuringiensis токсичных белков после такого длительного хранения.
1. Введение
В настоящее время комары представляют одну из самых серьезных угроз для здоровья населения из-за своей гематофагической природы и способности переносчиков. Некоторые роды, такие как Aedes, Anopheles, и Culex, , переносят патогены и паразиты (вирусы, простейшие или нематоды), вызывающие разрушительные заболевания, такие как денге, Зика, чикунгунья, энцефалит, желтая лихорадка, малярия и слоновость. которые в совокупности ответственны за высокую заболеваемость и смертность миллиардов людей, раскинувшихся почти на половине планеты [1–6].
Потребность в более экологически безопасных инсектицидах и повышенная устойчивость к химическим веществам предоставили прекрасную возможность уничтожить комаров с помощью биологических препаратов на основе Bacillus thuringiensis var. израильский (Bti) . Эти бактерии сохраняют параспоральные кристаллы и споры серотипа Н-14, которые при проглатывании личинками комаров солюбилизируются в щелочной среде средней кишки. Это приводит к активации инсектицидных белков кристалла, которые связываются с рецепторами в клеточной стенке и образуют кишечные поры, что приводит к гибели личинок. Этот инсектицидный эффект вызывают четыре токсина, известные как Cry4A, Cry4B, Cry11Aa и Cyt1A. Их основные признаки — высокая токсичность и специфичность по отношению к семейству Culicidae [7–9].] .
Эти бактерии сохраняют параспоральные кристаллы и споры серотипа Н-14, которые при проглатывании личинками комаров солюбилизируются в щелочной среде средней кишки. Это приводит к активации инсектицидных белков кристалла, которые связываются с рецепторами в клеточной стенке и образуют кишечные поры, что приводит к гибели личинок. Этот инсектицидный эффект вызывают четыре токсина, известные как Cry4A, Cry4B, Cry11Aa и Cyt1A. Их основные признаки — высокая токсичность и специфичность по отношению к семейству Culicidae [7–9].] .
С момента своего открытия и описания Гольдбергом и Маргалитом [10] Bti показал замечательную эффективность в уничтожении комаров, в отличие от его безвредности для людей и других млекопитающих, водных позвоночных, беспозвоночных и растений. Из-за этих характеристик коммерческие препараты этих бактерий были выбраны для программ борьбы с комарами [11–14]. Дулмейдж и др. [15] были одними из самых важных пионеров в разработке технологий для реализации Bti в качестве средства биологической борьбы с вредителями. Они установили различные методологии для массового производства, разработки продуктов и стандартизации мощности. В результате этих процессов несколько сотен экстрактов ферментации культур, принадлежащих этому микроорганизму, характеризующихся их инсектицидной активностью против двукрылых, были переданы в дар нашей исследовательской группе Министерством сельского хозяйства США в 1989 году. С тех пор эти экстракты хранятся в Международной коллекции энтомопатогенных бацилл Автономного университета Нуэво-Леона (UANL). Особенно важными в этой коллекции являются 20 экстрактов ферментации, которые мы решили использовать в этом исследовании, чтобы доказать их способность убивать комаров в лабораторных условиях за счет их остаточной активности.
Они установили различные методологии для массового производства, разработки продуктов и стандартизации мощности. В результате этих процессов несколько сотен экстрактов ферментации культур, принадлежащих этому микроорганизму, характеризующихся их инсектицидной активностью против двукрылых, были переданы в дар нашей исследовательской группе Министерством сельского хозяйства США в 1989 году. С тех пор эти экстракты хранятся в Международной коллекции энтомопатогенных бацилл Автономного университета Нуэво-Леона (UANL). Особенно важными в этой коллекции являются 20 экстрактов ферментации, которые мы решили использовать в этом исследовании, чтобы доказать их способность убивать комаров в лабораторных условиях за счет их остаточной активности.
2. Материалы и методы
2.1.
Bti Штаммы Bti Ферментационные экстракты из коллекции Dulmage et al. [15], восстановленные соосаждением лактозы с ацетоном в период с 1978 по 1983 гг. В течение этого периода экстракты хранили в темноте в сухом помещении исключительно для этой цели при °С в стерильных и герметичных флаконах. Двадцать четыре образца штамма HD-500 и двадцать пять образцов HD-567 исследовали под микроскопом с простым окрашиванием кумасси синим, чтобы убедиться в отсутствии загрязнения (рис. 1). Затем их активировали в чашках Петри и инкубировали в питательном агаре BD Bioxon в течение 72 часов, чтобы продемонстрировать их жизнеспособность, после чего отбирали образцы, демонстрирующие жизнеспособность.
Двадцать четыре образца штамма HD-500 и двадцать пять образцов HD-567 исследовали под микроскопом с простым окрашиванием кумасси синим, чтобы убедиться в отсутствии загрязнения (рис. 1). Затем их активировали в чашках Петри и инкубировали в питательном агаре BD Bioxon в течение 72 часов, чтобы продемонстрировать их жизнеспособность, после чего отбирали образцы, демонстрирующие жизнеспособность.
2.2. Комары
Личинки третьего и четвертого возрастов A. aegypti , используемые в этих экспериментах, были получены от инсектария Института биотехнологии Школы биологии УАНБ. Эта колония комаров постоянно поддерживается в свободных от патогенов условиях при температуре от 28 до 30°C, относительной влажности от 60 до 80% и циклах свет/темнота по 12 часов. В этих условиях цикл от яйца до взрослой особи завершается за три-четыре недели. Личинок ежедневно кормили предварительно стерилизованным кормом для собак мелкого помола (торговая марка Pedigree). Куколки удаляли ежедневно для контроля возраста комаров и помещали в контейнер, который помещали в клетку на 48 ч для появления взрослых комаров. В зависимости от величины популяции комаров использовали клетки разного размера, которых ежедневно кормили 10% раствором глюкозы, смоченным ватными тампонами, и каждые 3 дня источником крови в течение 10 мин. Яйцекладку самок стимулировали яйцекладкой, состоящей из емкости с водой, накрытой коричневой бумагой. Собранные яйца переносили в лотки для поддержания цикла таким образом, чтобы личинки, использованные во всех экспериментах, были доступны.
В зависимости от величины популяции комаров использовали клетки разного размера, которых ежедневно кормили 10% раствором глюкозы, смоченным ватными тампонами, и каждые 3 дня источником крови в течение 10 мин. Яйцекладку самок стимулировали яйцекладкой, состоящей из емкости с водой, накрытой коричневой бумагой. Собранные яйца переносили в лотки для поддержания цикла таким образом, чтобы личинки, использованные во всех экспериментах, были доступны.
2.3. Приготовление стандарта
В качестве положительного контроля (100% смертность) готовили первичный стандарт из VectoBac® 3000 UTI/мг (Valent BioSciences Corp. Libertyville, IL) при концентрации 0,05 млн. Его помещали в чашки Петри с питательным агаром. Отбирали бульон, переносили в питательный бульон и инкубировали при 30°С при 150 об/мин в течение 12 часов до достижения оптической плотности более 1 (2 × 10 8 КОЕ/мл), измеренной на спектрофотометре при длине волны 540 нм. было достигнуто. Аликвоту по 1 мл в трех повторах добавляли в колбы Эрленмейера на 500 мл со 100 мл 9Среда 0017 Bti (неопубликованная экспериментальная среда) для проверки активности экстрактов. В качестве отрицательного контроля использовали дистиллированную воду (рис. 1).
В качестве отрицательного контроля использовали дистиллированную воду (рис. 1).
2.4. Биоанализы
Соблюдались рекомендации Всемирной организации здравоохранения по лабораторным биоанализам бактериальных ларвицидов [16]. Суспензии каждого ферментационного экстракта готовили при концентрации 2000 ppm в колбах Эрленмейера. Затем были сделаны разведения для получения конечных концентраций 1000, 100, 10, 1, 0,1 и 0,01 соответственно. Использовали прозрачные пластиковые стаканчики вместимостью 250 мл по 150 мл на сосуд и добавляли 25 личинок второй или третьей стадии (рис. 1). Для расчета ЛД 50 ферментационных экстрактов готовили три суспензии 2%, 50% и 98%. Положительный контроль выполняли в двух повторностях с первичным стандартом. Результаты были сведены в таблицу в зависимости от дозы с учетом количества живых и мертвых комаров с 4 повторениями на обработку, выполненную в трех экземплярах через 24 часа. Для расчета LD 50 применяли линейную регрессию с использованием статистического пакета R, 2015 [17]. Биоанализы проводили не менее трех раз, и достоверность результатов оценивали с помощью первичного экстракта, полученного от VectoBac.
Биоанализы проводили не менее трех раз, и достоверность результатов оценивали с помощью первичного экстракта, полученного от VectoBac.
3. Результаты
Из 49 экстрактов ферментации Bti из коллекции только 20 все еще содержали споры в виде белковых кристаллов; поэтому в биоанализах использовались только они. Мертвых личинок подсчитывали каждые 6 часов в течение суток (табл. 1). В этом случае для расчета уровня смертности были включены умирающие личинки. Большинство этих экстрактов Bti проявляли некоторую токсическую активность в отношении личинок комаров в высоких концентрациях, но их активность снижалась по мере увеличения разбавления (таблица 1). Таким образом, при 1000 ppm до 18 экстрактов удавалось в той или иной степени убить личинок; на самом деле 10 экстрактов были эффективны на 100%. Такая же тенденция наблюдалась при 100 мд, где только экстракт из штамма 3299 не смог убить всех испытуемых насекомых, но при 10 ppm только 5 экстрактов сохраняли эту эффективность. Интересный факт наблюдался для экстракта штамма 3260. Даже в концентрациях 1 и 0,1 он сохранял свою токсическую активность неизменной, убивая всех личинок. Однако при более высоком разведении (0,01 ч/млн) экстракт не мог сохранять свою остаточную активность (рис. 2). Стоит отметить, что токсическая активность как коммерческого продукта ВектоБак, так и полученного из него лабораторного препарата (ВА) сохранялась даже при самых низких концентрациях в наших условиях эксперимента и вместе со штаммами 3260 и 3501 также проявляла устойчивую способность убивают личинок комаров при самых низких концентрациях. Таким образом, ЛД 50 и LD 98 были и ; и ; и и ppm для VectoBac, 3260 и 3501 соответственно (рис. 3).
Интересный факт наблюдался для экстракта штамма 3260. Даже в концентрациях 1 и 0,1 он сохранял свою токсическую активность неизменной, убивая всех личинок. Однако при более высоком разведении (0,01 ч/млн) экстракт не мог сохранять свою остаточную активность (рис. 2). Стоит отметить, что токсическая активность как коммерческого продукта ВектоБак, так и полученного из него лабораторного препарата (ВА) сохранялась даже при самых низких концентрациях в наших условиях эксперимента и вместе со штаммами 3260 и 3501 также проявляла устойчивую способность убивают личинок комаров при самых низких концентрациях. Таким образом, ЛД 50 и LD 98 были и ; и ; и и ppm для VectoBac, 3260 и 3501 соответственно (рис. 3).
4. Обсуждение
Наши результаты демонстрируют сохранение токсической активности экстрактов ферментации Bti против A. aegypti после трех десятилетий хранения. Все исследованные экстракты показали токсичность при самых высоких испытанных дозах (1000 млн), а некоторые экстракты из штаммов 3260 и 3501 по-прежнему убивали личинок даже при таких низких дозах, как 0,01 млн. Такие данные удивительны, так как ни одно исследование до сих пор не сообщало об активности B. thuringiensis токсичных белков после такого длительного хранения. С другой стороны, немногочисленные сообщения о стойкости токсичности в полевых условиях или в контролируемых условиях указывают на то, что эти белки быстро теряют свои инсектицидные свойства по разным причинам. К факторам окружающей среды, негативно влияющим на персистенцию токсичности, относятся температура [18], солнечная радиация [19], рН [20] и органические вещества [21]. Однако другие авторы показали, что некоторые условия благоприятствуют возможности увеличения их стойкости. Например, Саксена и др. [22] показали, что Cry-белки из корневых выделений Bt-кукурузы сохраняли свою ларвицидную активность в течение более 180 дней в почве, в то время как Tapp и Stotzky [23] сообщили об этой же токсической способности более чем через 234 дня после их внесения в почву. Вероятно, это связано с их связыванием с глинистыми частицами пористой матрицы.
Такие данные удивительны, так как ни одно исследование до сих пор не сообщало об активности B. thuringiensis токсичных белков после такого длительного хранения. С другой стороны, немногочисленные сообщения о стойкости токсичности в полевых условиях или в контролируемых условиях указывают на то, что эти белки быстро теряют свои инсектицидные свойства по разным причинам. К факторам окружающей среды, негативно влияющим на персистенцию токсичности, относятся температура [18], солнечная радиация [19], рН [20] и органические вещества [21]. Однако другие авторы показали, что некоторые условия благоприятствуют возможности увеличения их стойкости. Например, Саксена и др. [22] показали, что Cry-белки из корневых выделений Bt-кукурузы сохраняли свою ларвицидную активность в течение более 180 дней в почве, в то время как Tapp и Stotzky [23] сообщили об этой же токсической способности более чем через 234 дня после их внесения в почву. Вероятно, это связано с их связыванием с глинистыми частицами пористой матрицы. В нашем случае 9Белковые кристаллы 0017 Bti тестируемых экстрактов более трех десятилетий покрывали лактозной матрицей, используемой при получении экстракта ферментации. Это указывает на важную роль, которую может играть этот дисахарид в поддержании активности токсичных белков различных штаммов Bti , особенно стабильных после этого периода времени. У других разновидностей этой бактерии из той же коллекции экстрактов ферментации (неопубликованные данные), защитный механизм которых пока неясен, такого же эффекта не проявляется. Хотя активность экстрактов Bti оказался очень низким по сравнению с обработкой VectoBac, примечательно, что большинство из них сохраняли остаточную активность при самых высоких протестированных концентрациях, а два из этих экстрактов выделялись при минимальных концентрациях, при которых они могли убить личинок комаров. Это обнадеживающий признак возможности улучшения использования специальных штаммов и улучшенных составов для борьбы с насекомыми-переносчиками болезней.
В нашем случае 9Белковые кристаллы 0017 Bti тестируемых экстрактов более трех десятилетий покрывали лактозной матрицей, используемой при получении экстракта ферментации. Это указывает на важную роль, которую может играть этот дисахарид в поддержании активности токсичных белков различных штаммов Bti , особенно стабильных после этого периода времени. У других разновидностей этой бактерии из той же коллекции экстрактов ферментации (неопубликованные данные), защитный механизм которых пока неясен, такого же эффекта не проявляется. Хотя активность экстрактов Bti оказался очень низким по сравнению с обработкой VectoBac, примечательно, что большинство из них сохраняли остаточную активность при самых высоких протестированных концентрациях, а два из этих экстрактов выделялись при минимальных концентрациях, при которых они могли убить личинок комаров. Это обнадеживающий признак возможности улучшения использования специальных штаммов и улучшенных составов для борьбы с насекомыми-переносчиками болезней.
5. Выводы
Ферментационные экстракты из Bacillus thuringiensis вар. israelensis сохраняли свою остаточную токсическую активность в отношении личинок Aedes aegypti после хранения при °C в вышеупомянутых условиях в течение более трех десятилетий. Экстракты 3260 и 3501 показали LD 50 0,12 и 1,16 м.д. соответственно. Эта работа демонстрирует, что кристаллы белка Bti могут продлевать свою токсичность при хранении или в полевых условиях в определенных условиях.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
E. Calvez, L. Guillaumot, L. Millet et al., «Генетическое разнообразие и филогения Aedes aegypti, основного переносчика арбовирусов в Тихом океане», PLOS Забытые тропические болезни , об. 10, нет. 1, ID статьи e0004374, 2016 г.
Посмотреть по адресу: Сайт издателя | Google ScholarR. Eritja, R. Escosa, J.
Посмотреть по адресу: Сайт издателя | Google Scholar Lucientes et al., «Всемирное нашествие комаров-переносчиков: настоящее европейское распространение и проблемы для Испании», Биологические вторжения , том. 7, нет. 1, стр. 87–97, 2005 г.
Lucientes et al., «Всемирное нашествие комаров-переносчиков: настоящее европейское распространение и проблемы для Испании», Биологические вторжения , том. 7, нет. 1, стр. 87–97, 2005 г.Ф. Кюи, М. Раймонд и К.-Л. Qiao, «Устойчивость к инсектицидам у комаров-переносчиков в Китае», Pest Management Science , vol. 62, нет. 11, стр. 1013–1022, 2006.
Посмотреть по адресу: Сайт издателя | Google ScholarП. Готре и Ф. Саймон, «Денге, чикунгунья и Зика и массовые собрания: что произошло в Бразилии, 2014 г.», стр. 9.0017 Медицина путешествий и инфекционные заболевания , том. 14, нет. 1, стр. 7–8, 2016 г.
Посмотреть по адресу: Сайт издателя | Google ScholarH. Liu, Y. Lu, Q. Liu et al., «Сравнение устойчивости к пиретроидам у взрослых и личинок Culex pipiens pallens (Diptera: Culicidae) из четырех полевых популяций в Китае», Journal of Экономическая энтомология , вып.
Посмотреть по адресу: Сайт издателя | Академия Google 106, нет. 1, стр. 360–365, 2013 г.
106, нет. 1, стр. 360–365, 2013 г.C.B.Marcondes и M.D.F.F.D.M. Ximenes, «Вирус Зика в Бразилии и опасность заражения комарами aedes (Stegomyia)»,
Э. Бен-Дов, «Bacillus thuringiensis subsp. Israelensis и его специфичные для двукрылых токсины», Toxins , vol. 6, нет. 2014. Т. 4. С. 1222–1243.
Посмотреть по адресу: Сайт издателя | Google ScholarГ. П. Георгиу и М. К. Вирт, «Влияние воздействия одиночных и множественных токсинов Bacillus thuringiensis subsp. israelensis на развитие резистентности у комаров Culex quinquefasciatus (Diptera: Culicidae)», Applied and Environmental Microbiology , vol. 63, нет. 3, pp. 1095–1101, 1997.
Посмотреть по адресу: Google ScholarM.
Просмотр по адресу: Google Scholar C. Wirth, A. Delécluse, B.A. Federici, and W.E. Walton, Variable cross-resistance to Cry11 B из Bacillus thuringiensis subsp. jegathesan в culex quinquefasciatus (diptera: culicidae), устойчивых к одному или нескольким токсинам bacillus thuringienis subsp. израильский», Прикладная и экологическая микробиология , том. 64, нет. 11, pp. 4174–4179, 1998.
C. Wirth, A. Delécluse, B.A. Federici, and W.E. Walton, Variable cross-resistance to Cry11 B из Bacillus thuringiensis subsp. jegathesan в culex quinquefasciatus (diptera: culicidae), устойчивых к одному или нескольким токсинам bacillus thuringienis subsp. израильский», Прикладная и экологическая микробиология , том. 64, нет. 11, pp. 4174–4179, 1998.Л. Дж. Голдберг и Дж. Маргалит, «Бактериальная спора, демонстрирующая быструю ларвицидную активность против Anopheles sergentii, Uranotaenia ungui culata, Culex univitattus, Aedes aegypti и Culex pipiens», Mosquito News , vol. 37, pp. 355–358, 1977.
Просмотр по адресу: Google ScholarТ. М. Уотсон и Б. Х. Кей, «Компетентность вектора Aedes notoscriptus (Diptera: Culicidae) для вируса реки Росс в королеве Слэнд, Австралия». Журнал медицинской энтомологии , том. 35, нет. 2, стр. 104–106, 1998.
Посмотреть по адресу: Сайт издателя | Google ScholarA.
Посмотреть по адресу: Сайт издателя | Академия Google M. Boyd и B. H. Kay, «Векторная компетентность Aedes Aegypti, Culex Sitiens, Culex Annulirostris и Culex Quinquefasciatus (Diptera: Culicidae) для вируса леса Барма», Journal of Medical Entomolos , VoR8, VOL. 37, нет. 5, стр. 660–663, 2000.
M. Boyd и B. H. Kay, «Векторная компетентность Aedes Aegypti, Culex Sitiens, Culex Annulirostris и Culex Quinquefasciatus (Diptera: Culicidae) для вируса леса Барма», Journal of Medical Entomolos , VoR8, VOL. 37, нет. 5, стр. 660–663, 2000.Т. Л. Рассел, М. Д. Браун, Д. М. Пурди, П. А. Райан и Б. Х. Кей, «Эффективность составов VectoBac (разновидность Bacillus thuringiensis israelensis) для борьбы с комарами в Австралии», Journal of Economic Entomology , vol. 96, нет. 6, стр. 1786–1791, 2003.
Посмотреть по адресу: Сайт издателя | Google ScholarЛ. А. Лейси, «Bacillus thuringiensis серотипа Israelensis и Bacillus sphaericus для борьбы с комарами», Журнал Американской ассоциации по борьбе с комарами , том. 23, нет. 2, стр. 133–163, 2007 г.
Посмотреть по адресу: Сайт издателя | Google ScholarH. T. Dulmage, J. A. Correa и A.
Посмотреть по адресу: Сайт издателя | Google Scholar J. Martinez, «Соосаждение с лактозой как средство восстановления спорово-кристаллического комплекса Bacillus thuringiensis», Journal of Invertebrate Pathology , vol. 15, нет. 1, стр. 15–20, 1970.
J. Martinez, «Соосаждение с лактозой как средство восстановления спорово-кристаллического комплекса Bacillus thuringiensis», Journal of Invertebrate Pathology , vol. 15, нет. 1, стр. 15–20, 1970.Всемирная организация здравоохранения, «Руководство по лабораторным и полевым испытаниям ларвицидов от комаров», стр. 1–41, Женева, 2005 г.
Посмотреть по адресу: Google ScholarR Core Team, R: язык и среда для статистических вычислений , R Foundation for Statistical Computing, Вена, Австрия, 2014.
- 90 449 С. П. Райт, Д. Molloy, H. Jamnback и P. McCoy, «Влияние температуры и возраста на эффективность Bacillus thuringiensis var. israelensis и Bacillus sphaericus штамм 1593 против личинок aedes stimulans»,
Н.
Посмотреть по адресу: Google Scholar Беккер, М. Згомба, М. Людвиг, Д. Петрик и Ф. Ретич, «Факторы, влияющие на активность Bacillus thuringiensis var. israelensis», Journal of the American Mosquito Control Association , vol. 8, нет. 3, pp. 285–289, 1992.
Беккер, М. Згомба, М. Людвиг, Д. Петрик и Ф. Ретич, «Факторы, влияющие на активность Bacillus thuringiensis var. israelensis», Journal of the American Mosquito Control Association , vol. 8, нет. 3, pp. 285–289, 1992.C. Ignoffo, C. Garcia, M. Kroha, T. Fukuda, and T. Couch, «Laboratory Tests to Assessment the потенциальная эффективность Bacillus thuringiensis var. israelensis для использования против комаров», Mosquito News , vol. 41, pp. 85–93, 1981.
Просмотр по адресу: Google ScholarФ. В. Ван Эссен и С. К. Хембри, «Моделирование полевых исследований с использованием четырех составов Bacillus thuringiensis var. israelensis против комаров: остаточная активность и действие компонентов почвы», Mosquito News , vol. 42, нет. 1, pp. 66–72, 1982.
Просмотр по адресу: Google ScholarD. Saxena, S. Flores, and G. Stotzky, «Инсектицидный токсин в корневых экссудатах Bt-кукурузы», Природа , том.




 Lucientes et al., «Всемирное нашествие комаров-переносчиков: настоящее европейское распространение и проблемы для Испании», Биологические вторжения , том. 7, нет. 1, стр. 87–97, 2005 г.
Lucientes et al., «Всемирное нашествие комаров-переносчиков: настоящее европейское распространение и проблемы для Испании», Биологические вторжения , том. 7, нет. 1, стр. 87–97, 2005 г. 106, нет. 1, стр. 360–365, 2013 г.
106, нет. 1, стр. 360–365, 2013 г. C. Wirth, A. Delécluse, B.A. Federici, and W.E. Walton, Variable cross-resistance to Cry11 B из Bacillus thuringiensis subsp. jegathesan в culex quinquefasciatus (diptera: culicidae), устойчивых к одному или нескольким токсинам bacillus thuringienis subsp. израильский», Прикладная и экологическая микробиология , том. 64, нет. 11, pp. 4174–4179, 1998.
C. Wirth, A. Delécluse, B.A. Federici, and W.E. Walton, Variable cross-resistance to Cry11 B из Bacillus thuringiensis subsp. jegathesan в culex quinquefasciatus (diptera: culicidae), устойчивых к одному или нескольким токсинам bacillus thuringienis subsp. израильский», Прикладная и экологическая микробиология , том. 64, нет. 11, pp. 4174–4179, 1998. M. Boyd и B. H. Kay, «Векторная компетентность Aedes Aegypti, Culex Sitiens, Culex Annulirostris и Culex Quinquefasciatus (Diptera: Culicidae) для вируса леса Барма», Journal of Medical Entomolos , VoR8, VOL. 37, нет. 5, стр. 660–663, 2000.
M. Boyd и B. H. Kay, «Векторная компетентность Aedes Aegypti, Culex Sitiens, Culex Annulirostris и Culex Quinquefasciatus (Diptera: Culicidae) для вируса леса Барма», Journal of Medical Entomolos , VoR8, VOL. 37, нет. 5, стр. 660–663, 2000. J. Martinez, «Соосаждение с лактозой как средство восстановления спорово-кристаллического комплекса Bacillus thuringiensis», Journal of Invertebrate Pathology , vol. 15, нет. 1, стр. 15–20, 1970.
J. Martinez, «Соосаждение с лактозой как средство восстановления спорово-кристаллического комплекса Bacillus thuringiensis», Journal of Invertebrate Pathology , vol. 15, нет. 1, стр. 15–20, 1970. Беккер, М. Згомба, М. Людвиг, Д. Петрик и Ф. Ретич, «Факторы, влияющие на активность Bacillus thuringiensis var. israelensis», Journal of the American Mosquito Control Association , vol. 8, нет. 3, pp. 285–289, 1992.
Беккер, М. Згомба, М. Людвиг, Д. Петрик и Ф. Ретич, «Факторы, влияющие на активность Bacillus thuringiensis var. israelensis», Journal of the American Mosquito Control Association , vol. 8, нет. 3, pp. 285–289, 1992.