Как правильно использовать гидрогель для выращивания растений — Семена Успеха
Гидрогель – не просто модное словечко в лексиконе дачников и любителей комнатных растений. С его помощью можно практически творить чудеса.
Основные варианты, как и для чего использовать гидрогель
- Посадка в грунт с гидрогелем с целью сокращения полива. На 5 частей почвосмеси возьмите 1 часть напитавшегося водой гидрогеля. Для комнатных растений с поверхностной корневой системой гидрогель смешивают с верхним слоем почвы (примерная глубина – 10 см), а для растений с мощными корнями его распределяют на глубине около 20-30 см. Это позволит существенно сократить количество поливов, но при этом они должны стать более обильными, чтобы гель мог аккумулировать влагу.
- Проращивание семян. Измельчите мокрый гидрогель до однородной массы и выложите на дно прозрачной емкости слоем около 3 см.

- Выращивание рассады из семян. Возьмите 3-4 части земляной смеси на 1 часть сухих гранул. Заполните стаканчики для рассады землей, а сверху поместите гранулы. В слой гидрогеля поместите семена, полейте и накройте пленкой. После прорастания семян гидрогель будет стимулировать развитие корневой системы и увеличивать прирост биомассы.
- Постепенное внесение удобрений. Напитайте гидрогель не водой, а раствором удобрения. Концентрация раствора – как при поливе под корень. Используйте питательный гель при пересадке растений. Удобрения будут медленно поступать в почву, и это обеспечит пролонгированное действие питательного состава.
 Кроме того, это устранит солевые стрессы и эффект “скачкообразного роста” – побочные явления, которые наблюдаются при традиционном способе внесения удобрений с высокой растворимостью.
Кроме того, это устранит солевые стрессы и эффект “скачкообразного роста” – побочные явления, которые наблюдаются при традиционном способе внесения удобрений с высокой растворимостью.
- Укоренение черенков. Гидрогель защищает открытую корневую систему от пересыхания во время пересадки и ускоряет адаптацию на новом месте. Это эффективный метод для укоренения как черенков комнатных растений, так и саженцев деревьев. Окуните корни растения в гелевую массу и посадите в подготовленную лунку.
- Создание идеального газона. При закладке газона или во время осенней аэрации внесите под травяные рулоны сухие гранулы из расчета 50 г гранул на 1 кв.м. Это создаст под корнями растений водный буфер и поможет им сохранять отличный вид дерна даже в засушливое лето.
Посадка в гидрогель – находка для тех, кто постоянно заливает растения или, наоборот, подолгу отсутствует дома, заставляя зеленых питомцев выживать в условиях засухи. Также это решение можно посоветовать всем тем, кто любит экспериментировать с выращиванием растений, использовать ноу-хау и составлять о них собственное мнение. Попробуйте!
Также это решение можно посоветовать всем тем, кто любит экспериментировать с выращиванием растений, использовать ноу-хау и составлять о них собственное мнение. Попробуйте!
Экологичный гидрогель для сельского хозяйства
2241
Добавить в закладки
Ученые Томского политехнического университета вместе с коллегами из Чехии разработали новый гидрогель для сельского хозяйства. Его задача — удерживать влагу и удобрения в почве. Отличие нового гидрогеля от других разработок — он сделан полностью из природных компонентов и разлагается в почве на нетоксичные для человека, животных и растений составляющие. Результаты исследования опубликованы в журнале Journal of Cleaner Production (
IF: 7,246; Q1). Гидрогели используют в сельском и лесном хозяйстве для удержания
влаги в почве, а ее содержание напрямую влияет на всхожесть
семян. Также в них вводят удобрения, а за счет того, что гель не
дает удобрениям быстро испаряться, их можно вносить в меньшем
объеме.
Также в них вводят удобрения, а за счет того, что гель не
дает удобрениям быстро испаряться, их можно вносить в меньшем
объеме.
«Благодаря гидрогелям растения нужно реже поливать и можно
использовать меньше удобрений. Это важно для рационального
использования пресной воды на планете и снижает вредное
воздействие удобрений на почву. Большинство доступных на рынке
гидрогелей производят из полиакриламида и полиакрилонитрила. Они
не являются полностью биоразлагаемыми, поэтому сами по себе
считаются потенциальными загрязнителями почвы. Сами компоненты
нетоксичные, но коммерческие разработки содержат остаточные
количества акриламида, а это нейротоксичное и канцерогенное
вещество. Мы в качестве исходных компонентов использовали белок
молочной сыворотки и альгиновую кислоту. Это доступные и
натуральные компоненты, они абсолютно нетоксичные. В этом главное
преимущество нашего гидрогеля», — говорит один из авторов статьи,
доцент Исследовательской школы химических и биомедицинских
технологий ТПУ Антонио Ди Мартино.
Антонио Ди Мартино
Процесс получения гидрогеля, предложенного авторами исследования, прост: исходные компоненты необходимо смешать в растворе, высушить и спрессовать в виде таблетки. При контакте с жидкостью вещество становится гелеобразным и увеличивается в объеме.
«При получении смеси мы также добавляли в нее мочевину — это известное удобрение. С течением времени гидрогель разлагается в почве, за счет чего он постепенно и равномерно высвобождает удобрение. Кроме того, сам по себе гидрогель со временем разлагается до углерода и азота, а ведь азот — это наиболее широко используемый в сельском хозяйстве макроэлемент, важнейший строительный материал для растений. При этом эксперименты в лаборатории показали, что гидрогель после полной отдачи влаги можно использовать еще несколько раз», — отмечает Антонио Ди Мартино.
В дальнейшем ученые продолжат эксперименты и поиск новых
материалов для контролируемого ввода удобрений в почву.
В исследовании принимали участие ученые из Университета Томаша Бати в Злине (Чехия), Исследовательского института молочной промышленности (Чехия) и Научно-исследовательского института почв и водосбережения (Чехия).
Информация и фото предоставлены пресс-службой Томского политехнического университета
Автор Пресс-Служба ТПУ
Разместила Наталья Сафронова
ТПУ антонио ди мартино гидрогель почва
Источник: news.tpu.ru
Информация предоставлена Информационным агентством “Научная Россия”. Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
Гидрогель Skintegrity | Гидрогелевые повязки Средства по уходу за ранами
Skintegrity Hydrogel | Гидрогелевые повязки Средства по уходу за ранами Перейти к основному содержанию Skintegrity® Hydrogel поддерживает влажную среду, отдавая влагу сухим ранам или ранам с минимальным экссудатом.
Медлайн Индастриз, Инк.
Medline Industries, Inc. предлагает инновационные продукты и услуги по уходу за ранами и кожей.Бесплатный номер: (800) 633-5463 Факс: (800) 351-1512 Веб-сайт: www.medline.com
Преимущества
• На водной основе
• Прозрачный
• Нежирный
• Содержит глицерин, чтобы вязкий состав оставался на раневом ложе
• Содержит алоэ
• Флакон с мехом на 1 унцию для целенаправленного применения
Показания 90 005
Skintegrity® Hydrogel показан для использования при пролежнях, частичных и полнослойных ранах, язвах нижних конечностей, хирургических ранах, ожогах первой и второй степени, рваных ранах, ссадинах и разрывах кожи.
Противопоказания
Противопоказано применять у пациентов с известной чувствительностью к компонентам геля или при сильно дренирующих ранах.
Способ поставки/Размеры
Сильфоны: 1 унция. Трубка: 4 унции.
Код HCPCS
Характеристики продукта
отменить Доступен антимикробный формат
check_circle Очистить
check_circle Совместимость с темами
check_circle Легко приспосабливается к ране
отменить Ограниченный срок годности
отменить Паропроницаемый
отменить Порошковая форма
check_circle Сохранившаяся многократная доза
check_circle Требуется вторичная перевязка
отменить Неконсервированная стандартная доза
check_circle Можно использовать на инфицированных ранах
Прочие характеристики
check_circle Доступны учебные материалы
чек_круг Доступны бесплатные образцы/пробные версии
отменить Доступна опубликованная клиническая статья
Рекомендуемое применение
Острые раны
Ожоги
Ожоги первой и второй степени
Язвы на ногах
Раны без/минимально экссудирующие
Раны частичной и полной толщины
Пролежни 900 27 Поверхностные раны
Хирургические раны
Венозные Язвы
Способ использования/применения
Выдавите гидрогель Skintegrity® на палец или аппликатор в перчатке. Обильно покройте рану, равномерно распределив. Накройте соответствующей вторичной повязкой.
Обильно покройте рану, равномерно распределив. Накройте соответствующей вторичной повязкой.
Частота удаления и замены
Skintegrity® можно оставлять на срок до 3 дней. Частота смены повязки будет зависеть от количества отделяемого.
Дополнительные рекомендуемые повязки
Stratasorb® Composite, марлевая марля, Suresite® 123+ Pad.
Клинически испытано
Не содержит латекс
Нецитотоксичен
Не вызывает раздражения
Нет плакатов, соответствующих выбранным фильтрам. Удалите некоторые фильтры или сбросьте их и начните заново.
Современные повязки для ран: Гидрогелевые повязки
1. Мартиненго Л., Олссон М., Байпай Р., Соляк М., Аптон З., Шмидтхен А., Кар Дж., Ярбринк К. Распространенность хронических ран среди населения в целом : Систематический обзор и метаанализ обсервационных исследований. Анна. Эпидемиол. 2019;29:8–15. doi: 10.1016/j.annepidem.2018.10.005. [PubMed] [CrossRef] [Google Scholar]
2.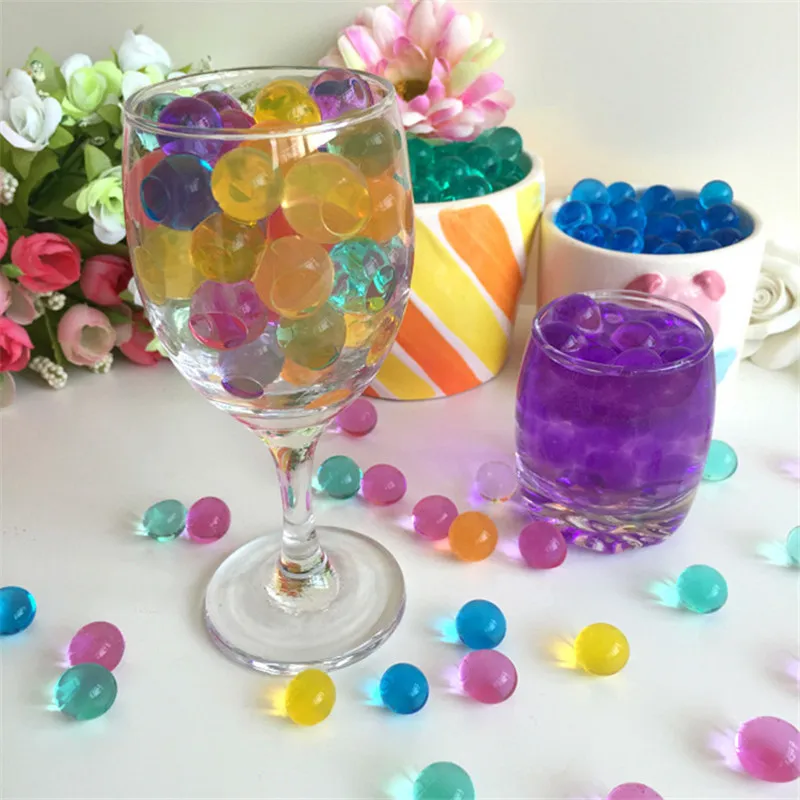 Нуссбаум С.Р., Картер М.Дж., Файф К.Е., ДаВанцо Дж., Хоут Р., Нусгарт М., Картрайт Д. Экономическая оценка воздействия, стоимости и политики Medicare Последствия хронических незаживающих ран. Цените здоровье. 2018;21:27–32. doi: 10.1016/j.jval.2017.07.007. [PubMed] [CrossRef] [Академия Google]
Нуссбаум С.Р., Картер М.Дж., Файф К.Е., ДаВанцо Дж., Хоут Р., Нусгарт М., Картрайт Д. Экономическая оценка воздействия, стоимости и политики Medicare Последствия хронических незаживающих ран. Цените здоровье. 2018;21:27–32. doi: 10.1016/j.jval.2017.07.007. [PubMed] [CrossRef] [Академия Google]
3. Алвен С., Адерибигбе Б.А. Гидрогели на основе хитозана и целлюлозы для лечения ран. Междунар. Дж. Мол. науч. 2020;21:9656. doi: 10.3390/ijms21249656. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
4. Максимова Н.В., Люндуп А.В., Любимов Р.О., Мельниченко Г.А., Николенко В.Н. Патофизиологические аспекты заживления ран при нормальной и диабетической стопе. Анна. Русь. акад. Мед. науч. 2014;69:110–117. doi: 10.15690/vramn.v69i11-12.1192. [PubMed] [CrossRef] [Академия Google]
5. Соломенников А.В., Тюкавин А.И., Арсеньев Н.А. Влияние дегрануляции тромбоцитов на формирование локального воспалительного процесса. Дж. Мед. биол. Стад. 2019;7:280–289. doi: 10.17238/issn2542-1298. 2019.7.3.280. [CrossRef] [Google Scholar]
2019.7.3.280. [CrossRef] [Google Scholar]
6. Гатак С., Майтин Е.В., Мак Дж.А., Хаскалл В.К., Атанелишвили И., Морено Родригес Р., Марквальд Р.Р., Мисра С. Роль протеогликанов и гликозаминогликанов в заживлении ран и фиброзе. Междунар. Дж. Клеточная биология. 2015;2015:834893. дои: 10.1155/2015/834893. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Авишай Э., Егиазарян К., Голубницкая О. Нарушение заживления ран: факты и гипотезы для мультипрофессиональных соображений в области прогнозирования, профилактики и персонализации лекарство. EPMA J. 2017; 8: 23–33. doi: 10.1007/s13167-017-0081-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Martin P., Nunan R. Клеточные и молекулярные механизмы восстановления при остром и хроническом заживлении ран. бр. Дж. Дерматол. 2015; 173:370–378. дои: 10.1111/bjd.13954. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Дхивья С., Падма В.В., Сантини Э. Раневые повязки — обзор. Биомедицина. 2015;5:22. doi: 10.7603/s40681-015-0022-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Биомедицина. 2015;5:22. doi: 10.7603/s40681-015-0022-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
10. Савина И.Н., Зугаиб М., Ергешов А.А. Разработка и оценка биоразлагаемых макропористых криогелей в качестве передовых материалов для инженерии тканей и носителей лекарств. Гели. 2021;7:79. doi: 10.3390/gels7030079. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Сун С.-К., Ке С.-Дж., Линь Ю.-В., Лин Ф.-Х., Цай Т.-Х., Сун Дж.-С. Трансглютаминазный сшитый желатин-альгинат-антибактериальный гидрогель в качестве покрытия для доставки лекарств при инфекциях, связанных с имплантатами. Полимеры. 2021;13:414. doi: 10.3390/polym13030414. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Сабир Ф., Катона Г., Исмаил Р., Сипос Б., Амбрус Р., Чока И. Развитие и характеристика н-пропилгаллата Инкапсулированный гидрогель с твердыми липидными наночастицами для интраназальной доставки. Фармацевтика. 2021;14:696. doi: 10.3390/ph24070696. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
[Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
13. Эскенс О., Виллани Г., Амин С. Реологическое исследование термочувствительных гелей альгината-метилцеллюлозы для приготовления эпидермального фактора роста. Косметика. 2021;8:3. doi: 10.3390/cosmetics8010003. [CrossRef] [Google Scholar]
14. Doostmohammadi M., Ameri A., Mohammadinejad R., Dehghannoudeh N., Banat I.M., Ohadi M., Dehghannoudeh G. Гидрогели для доставки пептидных гормонов: применение в терапевтических и тканевых технологиях. Дизайн лекарств, разработка и терапия. Препарат Дез. Девел. тер. 2019;13:3405–3418. doi: 10.2147/DDDT.S217211. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Барилло Д.Дж., Барилло А.Р., Корн С., Лам К., Аттар П.С. Антимикробный спектр Xeroform ® Ожоги. 2017;43:1189–1194. doi: 10.1016/j.burns.2016.10.023. [PubMed] [CrossRef] [Google Scholar]
16. Сильва Х.М., Перейра С.В., Мано Ф., Сильва Э., Кастро В.И.Б., Са-Ногейра И., Рейс Р. Л., Пайва А., Матиас А.А., Дуарте А.Р.К. Терапевтическая роль растворителей глубокой эвтектики на основе ментола и насыщенных жирных кислот при заживлении ран. Приложение ACS Био Матер. 2019;2:4346–4355. doi: 10.1021/acsabm.9b00598. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Л., Пайва А., Матиас А.А., Дуарте А.Р.К. Терапевтическая роль растворителей глубокой эвтектики на основе ментола и насыщенных жирных кислот при заживлении ран. Приложение ACS Био Матер. 2019;2:4346–4355. doi: 10.1021/acsabm.9b00598. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Пилехвар-Солтанахмади Ю., Дадашпур М., Мохаджери А., Фаттахи А., Шервалилоу Р., Заргами Н. Обзор применения натуральных Вещества, включаемые в электропряденые нановолоконные каркасы, для разработки инновационных перевязочных материалов для ран. Мини Преподобный Мед. хим. 2018;18:414–427. doi: 10.2174/1389557517666170308112147. [PubMed] [CrossRef] [Google Scholar]
18. Пшекора А.А. Краткий обзор тканевой инженерии искусственных кожных трансплантатов для лечения хронических ран: можем ли мы реконструировать функциональную ткань кожи in vitro. Клетки. 2020;9:1622. doi: 10.3390/cells9071622. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Абруццо А., Каппадоне К. , Саллюстио В., Пиконе Г., Росси М., Николетта Ф.П., Луппи Б., Бигуччи Ф., Черкиара Т. Разработка повязок из испанского ракитника и льна с пленками, наполненными глицирретиновой кислотой, для заживления ран. Характер. оценка биол. Проп. фарм. 2021;13:1192. doi: 10.3390/фармацевтика13081192. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Саллюстио В., Пиконе Г., Росси М., Николетта Ф.П., Луппи Б., Бигуччи Ф., Черкиара Т. Разработка повязок из испанского ракитника и льна с пленками, наполненными глицирретиновой кислотой, для заживления ран. Характер. оценка биол. Проп. фарм. 2021;13:1192. doi: 10.3390/фармацевтика13081192. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Ассис А.К.Л.д., Морейра Л.М.К.д.К., Роча Б.П., Перейра М.Р.Б., де Мело Д.Ф., Моура Р.О.д., Азеведу Е.П.д., Оширо-Джуниор Дж.А., Дам asceno B.P.G.d.L. Пленки ацетата целлюлозы, нагруженные производными N-ацилгидразона: термоаналитическая, спектроскопическая, механическая и морфологическая характеристика. Полимеры. 2021;13:2345. дои: 10.3390/polym13142345. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Michelin R.M., Ahdoot E., Zakhary B.L., McDowell M., French M. Выбор оптимальной повязки для купания после тотального эндопротезирования коленного сустава. Дж. Артропласт. 2021; 36: 970–977. doi: 10.1016/j. arth.2020.09.023. [PubMed] [CrossRef] [Google Scholar]
arth.2020.09.023. [PubMed] [CrossRef] [Google Scholar]
22. Ван Ю.-К., Ли Х.-К., Чен К.-Л., Куо М.-К., Рамачандран С., Чен Р.- Ф., Куо Ю.-Р. Влияние пенных повязок, высвобождающих серебро, на заживление диабетической язвы стопы. Дж. Клин. Мед. 2021;10:1495. doi: 10.3390/jcm10071495. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Вивчаренко В., Войчик М., Палка К., Пшекора А. Высокопористый и сверхабсорбирующий биоматериал, изготовленный из полисахаридов морского происхождения и аскорбиновой кислоты в качестве Оптимальная повязка для лечения экссудирующих ран. Материалы. 2021;14:1211. doi: 10.3390/ma14051211. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Shi C., Wang C., Liu H., Li Q., Li R., Zhang Y., Liu Y., Shao Y. , Ван Дж. Выбор подходящей повязки для различных ран. Передний. биоинж. Биотехнолог. 2020;8:182. дои: 10.3389/fbioe.2020.00182. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Westby M.J., Dumville J. C., Soares M.O., Stubbs N., Norman G. Повязки и местные средства для лечения пролежней. Кокрановская система баз данных. Ред. 2017; 6:CD006876. doi: 10.1002/14651858.CD011947.pub2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
C., Soares M.O., Stubbs N., Norman G. Повязки и местные средства для лечения пролежней. Кокрановская система баз данных. Ред. 2017; 6:CD006876. doi: 10.1002/14651858.CD011947.pub2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Каминская М.С., Цыбульская А.М., Сконечна-Жидецкая К., Августынюк К., Гроханс Э., Каракевич Б. Эффективность гидроколлоидных повязок при лечении пролежней у взрослых пациентов: систематический обзор и метаанализ. Междунар. Дж. Окружающая среда. Рез. Здравоохранение. 2020;17:7881. дои: 10.3390/ijerph27217881. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Lee OJ, Kim JH, Moon B.M., Chao JR, Yoon J., Ju HW, Lee JM, Park HJ, Kim DW, Kim SJ, и другие. Изготовление и характеристика гидроколлоидной повязки с наночастицами фиброина шелка для заживления ран. Ткань англ. Реген. Мед. 2016;13:218–226. doi: 10.1007/s13770-016-9058-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Weller C.D., Team V. , Sussman G. Обновление интерактивной перевязки ран первой линии: всесторонний обзор доказательств. Передний. Фармакол. 2020;11:155. дои: 10.3389/fфар.2020.00155. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Sussman G. Обновление интерактивной перевязки ран первой линии: всесторонний обзор доказательств. Передний. Фармакол. 2020;11:155. дои: 10.3389/fфар.2020.00155. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Мофаззал Джахроми М.А., Саханди Зангабад П., Мусави Басри С.М., Саханди Зангабад К., Гамарипур А., Ареф А.Р., Карими М., Хамблин М.Р. Наномедицина и передовые технологии лечения ожогов: Предотвращение инфекции и облегчение заживления ран. Доп. Наркотик Делив. 2018; 123:33–64. doi: 10.1016/j.addr.2017.08.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Таваколи С., Клар А.С. Усовершенствованные гидрогели в качестве повязок для ран. Биомолекулы. 2020;10:1169. doi: 10.3390/biom10081169. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Василе К., Памфил Д., Столеру Э., Байкан М. Новые разработки в области медицинского применения гибридных гидрогелей, содержащих природные полимеры. Молекулы. 2020;25:1539. doi: 10,3390/молекулы25071539. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
doi: 10,3390/молекулы25071539. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
32. Гунько В.М., Савина И.Н., Михаловский С.В. Свойства воды, связанной в гидрогелях. Гели. 2017;3:37. doi: 10.3390/gels3040037. [Перекрестная ссылка] [Академия Google]
33. Wang H., Heilshorn S.C. Адаптируемые гидрогелевые сети с обратимыми связями для тканевой инженерии. Доп. Матер. 2015;27:3717–3736. doi: 10.1002/adma.201501558. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Дабири Г., Дамстеттер Э., Филлипс Т. Выбор раневой повязки на основе общих характеристик раны. Доп. Уход за раной. 2016;5:32–41. doi: 10.1089/рана.2014.0586. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Du X., Zhou J., Shi J., Xu B. Супрамолекулярные гидрогельаторы и гидрогели: от мягкой материи к молекулярным биоматериалам. хим. 2015; 115:13165–13307. doi: 10.1021/acs.chemrev.5b00299. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Башир С., Хина М., Икбал Дж., Раджпар А.Х., Муджтаба М.А., Альгамди Н.А., Вагех С., Рамеш К., Рамеш С. Основные понятия гидрогелей: синтез, свойства и их применение. Полимеры. 2020;12:2702. doi: 10.3390/polym12112702. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Башир С., Хина М., Икбал Дж., Раджпар А.Х., Муджтаба М.А., Альгамди Н.А., Вагех С., Рамеш К., Рамеш С. Основные понятия гидрогелей: синтез, свойства и их применение. Полимеры. 2020;12:2702. doi: 10.3390/polym12112702. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
37. Rebers L., Reichsöllner R., Regett S., Tovar G., Borchers K., Baudis S., Southan A. Дифференциация физического и химическая сшивка в желатинметакрилоилгидрогелях. науч. Респ. 2021; 11:3256. дои: 10.1038/s41598-021-82393-з. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Морелло Г., Полини А., Скалера Ф., Риццо Р., Джильи Г., Джервазо Ф. Подготовка и характеристика солевых инъекций Термочувствительные гидрогели хитозан/пектин для встраивания и культивирования клеток. Полимеры. 2021;13:2674. doi: 10.3390/polym13162674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. O’Meara S., Martyn-St J., Adderley M.U.J. Альгинатные повязки при венозных язвах голени. Кокрановская система баз данных. Версия 2015; 2015:CD010182. doi: 10.1002/14651858.CD010182.pub3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Версия 2015; 2015:CD010182. doi: 10.1002/14651858.CD010182.pub3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Эшалье С., Лорин В., Мартинес Дж., Мехди А., Жиль С. Материалы сегодня, коммуникации. Том 20. Эльзевир; Амстердам, Нидерланды: 2019. Методы химического сшивания для инкапсуляции клеток в гидрогели; п. 100536. [CrossRef] [Google Scholar]
41. Chang N.S., Lin R., Sze C.I., Aqeilan R.I. Передовая статья: Белки домена WW в передаче сигналов, росте рака, нервных заболеваниях и нарушениях обмена веществ. Передний. Онкол. 2019;9:719. doi: 10.3389/fonc.2019.00719. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Браун Б.Н., Бадылак С.Ф. Внеклеточный матрикс как индуктивный каркас для функциональной реконструкции тканей. Перевод Рез. 2014; 163: 268–285. doi: 10.1016/j.trsl.2013.11.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Xin H., Biswas N., Li P., Zhong C., Chan T.C., Nudleman E., Ferrara N. Гепарин-связывающие варианты VEGFR1 в качестве ингибиторов VEGF длительного действия для лечения внутриглазных неоваскулярных заболеваний. проц. Натл. акад. науч. США. 2021;118:e1921252118. doi: 10.1073/pnas.1921252118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Гепарин-связывающие варианты VEGFR1 в качестве ингибиторов VEGF длительного действия для лечения внутриглазных неоваскулярных заболеваний. проц. Натл. акад. науч. США. 2021;118:e1921252118. doi: 10.1073/pnas.1921252118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Zhang X., Tan B., Wu Y., Zhang M., Liao J. Обзор гидрогелей с фототермическим эффектом при заживлении ран и инженерия костной ткани. Полимеры. 2021;13:2100. doi: 10.3390/polym13132100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Верхелст С., Бонгер К.М., Виллемс Л.И. Биоортогональные реакции в профилировании белков на основе активности. Молекулы. 2020;25:5994. doi: 10,3390/молекулы25245994. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Гупта А., Бриффа С.М., Свинглер С., Гибсон Х., Каннаппан В., Адамус Г., Ковальчук М., Мартин С., Радецка И. Синтез наночастиц серебра с использованием куркумина-циклодекстринов, загруженных в бактериальную целлюлозу Гидрогели на основе для перевязки ран. Биомакромолекулы. 2020; 21: 1802–1811. doi: 10.1021/acs.biomac.9b01724. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Биомакромолекулы. 2020; 21: 1802–1811. doi: 10.1021/acs.biomac.9b01724. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Нешович К., Янкович А., Койич В., Вукашинович-Секулич М., Перич-Груич А., Ри К.Ю., Мишкович-Станкович В. , Гидрогели серебро/поли(виниловый спирт)/хитозан/графен – синтез, биологические и физико-химические свойства и кинетика высвобождения серебра. Композиции Часть Б англ. 2018;154:175–185. doi: 10.1016/j.compositesb.2018.08.005. [Перекрестная ссылка] [Академия Google]
48. Sun A., He X., Li L., Li T., Liu Q., Zhou X., Ji X., Li W., Qian Z. Фотополимеризованный гидрогель для инъекций с антимикробными и биосовместимыми свойствами для инфицированных регенерация кожи. NPG Азия Матер. 2020;12:25. doi: 10.1038/s41427-020-0206-y. [CrossRef] [Google Scholar]
49. Абдоллахи З., Заре Е.Н., Салими Ф., Гударзи И., Тай Ф.Р., Макванди П. Биоактивные гидрогели на основе карбоксиметилкрахмала, украшенные наночастицами CuO: антиоксидантные и антимикробные свойства и ускорение ранения Исцеление в естественных условиях. Междунар. Дж. Мол. науч. 2021;22:2531. дои: 10.3390/ijms22052531. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Междунар. Дж. Мол. науч. 2021;22:2531. дои: 10.3390/ijms22052531. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Kong L., Wu Z., Zhao H., Cui H., Shen J., Chang J., Li H., He Y. Биоактивные гидрогели для инъекций, содержащие десферриоксамин и биостекло, для заживления диабетических ран. СКУД. заявл. Матер. Интерфейсы. 2018;10:30103–30114. doi: 10.1021/acsami.8b09191. [PubMed] [CrossRef] [Google Scholar]
51. Dong Y., Cui M., Qu J., Wang X., Kwon S.H., Barrera J., Elvassore N., Gurtner G.C. Конформный гидрогель гиалуроновой кислоты доставляет стволовые клетки жировой ткани и способствует регенерации после ожогов. Акта Биоматер. 2020;108:56–66. doi: 10.1016/j.actbio.2020.03.040. [PubMed] [CrossRef] [Академия Google]
52. Грихальво С., Эритья Р., Диас Д. Материаловедение и технология. Wiley-VCH Verlag GmbH & Co. KGaA; Вайнхайм, Германия: 2019. Гидрогели липосомы в хитозане. Проблемы и возможности для биомедицинских приложений. [Google Scholar]
53. Oryan A., Jalili M., Kamali A., Nikahval B. Одновременное использование пробиотических микроорганизмов и гидрогеля/каркаса коллагена улучшает заживление ожоговых ран: оценка in vivo. Бернс. 2018; 7: 1775–1786. doi: 10.1016/j.burns.2018.05.016. [PubMed] [CrossRef] [Академия Google]
Oryan A., Jalili M., Kamali A., Nikahval B. Одновременное использование пробиотических микроорганизмов и гидрогеля/каркаса коллагена улучшает заживление ожоговых ран: оценка in vivo. Бернс. 2018; 7: 1775–1786. doi: 10.1016/j.burns.2018.05.016. [PubMed] [CrossRef] [Академия Google]
54. Ying H., Zhou J., Wang M., Su D., Ma Q., Lv G., Chen J. Образованный in situ гидрогель коллаген-гиалуроновая кислота в качестве биомиметической повязки для ускорения спонтанного заживления ран. Матер. науч. англ. C Матер. биол. заявл. 2019; 101: 487–498. doi: 10.1016/j.msec.2019.03.093. [PubMed] [CrossRef] [Google Scholar]
55. Ван П., Хуан С., Ху З., Ян В., Лан Ю., Чжу Дж., Ханчароу А., Го Р., Тан Б. Ин situ образовали противовоспалительную гидрогелевую загрузку плазмидной ДНК, кодирующей VEGF, для заживления ожоговых ран. Акта Биоматер. 2019;100:191–201. doi: 10.1016/j.actbio.2019.10.004. [PubMed] [CrossRef] [Google Scholar]
56. Миллер К.Дж., Браун Д.А., Ибрагим М.М., Рамчал Т. Д., Левинсон Х. МикроРНК в инженерии тканей кожи. Доп. Наркотик Делив. 2015; 88:16–36. doi: 10.1016/j.addr.2015.04.018. [PubMed] [CrossRef] [Google Scholar]
Д., Левинсон Х. МикроРНК в инженерии тканей кожи. Доп. Наркотик Делив. 2015; 88:16–36. doi: 10.1016/j.addr.2015.04.018. [PubMed] [CrossRef] [Google Scholar]
57. Ларуш Д., Кантин-Уоррен Л., Десганье М., Гиньяр Р., Мартель И., Аюб А., Лавуа А., Говен Р., Оже Ф.А. , Мулен В.Дж. и др. Усовершенствованные методы производства тканеинженерных заменителей кожи, подходящих для постоянного закрытия повреждений кожи на всю толщину. БиоРес. Открытый доступ. 2016;5:320–329. doi: 10.1089/biores.2016.0036. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Li P., Guo X. Обзор: Терапевтический потенциал стволовых клеток, полученных из жировой ткани, в заживлении и регенерации кожных ран. Стволовые клетки Res. тер. 2018;9:302. doi: 10.1186/s13287-018-1044-5. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
59. Zhao J., Hu L., Liu J., Gong N., Chen L. Эффекты цитокинов в среде, кондиционированной жировыми стволовыми клетками, на миграция и пролиферация фибробластов кожи in vitro. Биомед. Рез. Междунар. 2013;2013:578479. doi: 10.1155/2013/578479. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Retracted
Биомед. Рез. Междунар. 2013;2013:578479. doi: 10.1155/2013/578479. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Retracted
60. An Y., Li C., Xu Q., Sun Y., Wang Z. Экзосомы из мезенхимальных стволовых клеток, полученных из жировой ткани, могут способствовать образованию фибробластов Пролиферация, миграция и синтез коллагена посредством активации сигнального пути Wnt/β-катенина во время заживления ран. 2021. [(по состоянию на 30 августа 2021 г.)]. Доступно в Интернете: https://assets.researchsquare.com/files/rs-520642/v1/d9e406e0-e2d0-4bde-a65f-72c4922bb94f.pdf?c=1621279716
61. Ma H., Lam P.K., Siu W.S., Tong C.S.W., Lo K.K.Y., Koon C.M., Wu X.X., Li X., Cheng W., Shum W.T., et al. Мезенхимальные стволовые клетки, полученные из жировой ткани (ADMSC), и полученный из ADMSC секретом ускоряют заживление ран на модели грызунов — предварительное исследование. клин. Космет. расследование Дерматол. 2021; 14: 753–764. doi: 10.2147/CCID.S298105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Lu T.-Y., Yu K.-F., Kuo S.-H., Cheng N.-C., Chuang E. -Y., Yu J. Сшитый ферментом желатиновый гидрогель со сфероидом стволовых клеток, полученным из жировой ткани, облегчающий заживление ран в модели ожога у мышей. Полимеры. 2020;12:2997. doi: 10.3390/polym12122997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Lu T.-Y., Yu K.-F., Kuo S.-H., Cheng N.-C., Chuang E. -Y., Yu J. Сшитый ферментом желатиновый гидрогель со сфероидом стволовых клеток, полученным из жировой ткани, облегчающий заживление ран в модели ожога у мышей. Полимеры. 2020;12:2997. doi: 10.3390/polym12122997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Ян М., Хе С., Су З., Ян З., Лян Х., Ву И. Термочувствительный инъекционный хитозан/коллаген/β- Глицерофосфатные композитные гидрогели для улучшения заживления ран путем инкапсуляции мезенхимальных сфероидов стволовых клеток. СКУД. Омега. 2020;5:21015–21023. doi: 10.1021/acsomega.0c02580. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Robert A.W., Azevedo Gomes F., Rode M.P., Marques da Silva M., Veleirinho M.B.D.R., Maraschin M., Hayashi L., Wosgrau Calloni G. ., Стимамиглио М.А. Потенциал регенерации кожи проангиогенного секретома мультипотентных стромальных клеток, полученных из кожи человека. Дж. Тиссью Инж. 2019;10:2041731419833391. doi: 10.1177/2041731419833391. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1177/2041731419833391. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
65. Smith O.J., Kanapathy M., Khajuria A., Prokopenko M., Hachach-Haram N., Mann H., Mosahebi A. Систематический обзор эффективность липофилинга и обогащенной тромбоцитами плазмы для заживления ран. Междунар. Раненый Дж. 2018; 15: 519–526. doi: 10.1111/iwj.12892. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Семенич Д., Цирман Т., Рожман П., Смрке Д.М. Регенерация хронических ран с помощью аллогенного геля тромбоцитов по сравнению с лечением гидрогелем: проспективное исследование. Акта Клин. хорват. 2018; 57: 434–442. doi: 10.20471/согласно 2018.57.03.05. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Де Анджелис Б., Д’Аутилио М.Ф.Л.М., Орланди Ф., Пепе Г., Гаркович С., Сиоли М.Г., Орланди А., Червелли В., Джентиле П. Заживление ран: оценка in vitro и in vivo биофункционализированный каркас на основе гиалуроновой кислоты и богатой тромбоцитами плазмы при хронических язвах.


 Кроме того, это устранит солевые стрессы и эффект “скачкообразного роста” – побочные явления, которые наблюдаются при традиционном способе внесения удобрений с высокой растворимостью.
Кроме того, это устранит солевые стрессы и эффект “скачкообразного роста” – побочные явления, которые наблюдаются при традиционном способе внесения удобрений с высокой растворимостью.